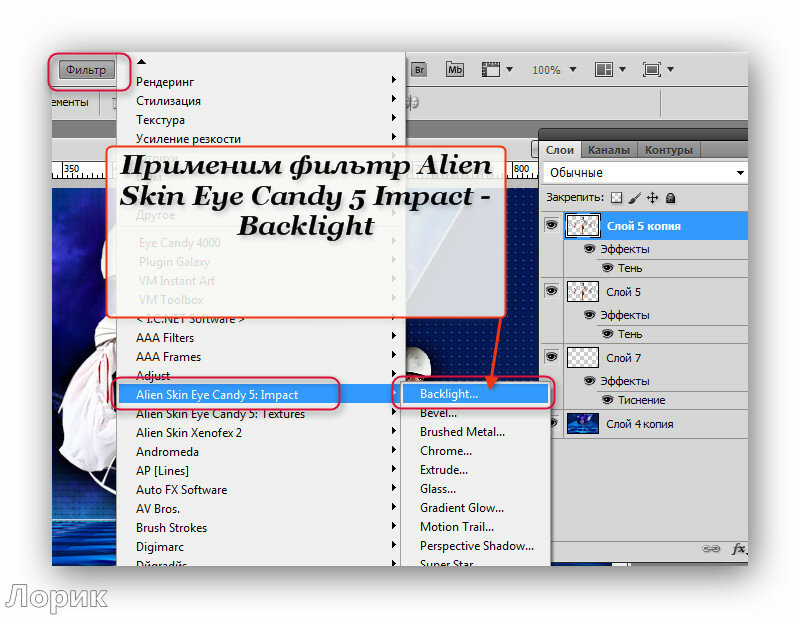
Как добавить шрифт в Фотошоп • ARTshelter
В этом простом уроке я покажу вам, где можно скачать и как добавить шрифт в Фотошоп.
Где скачать шрифт
Скачать бесплатные шрифты можно на сайтах dafont.com или Google Fonts. На обоих ресурсах достаточно большая коллекция свободных шрифтов, так что вам не составит труда выбрать подходящий.
Чтобы скачать шрифт с DaFont, переходим на сайт по ссылке. Для поиска шрифта вы можете воспользоваться удобной навигацией по стилям, начертаниям и т.д. или поисковой строкой.
Подобрав нужный шрифт, вы можете перейти на страницу с подробной информацией о нем, или сразу нажать на кнопку Download (Скачать) напротив названия.
Для того, чтобы скачать шрифт с Google Fonts, переходим на сайт fonts.google.com. С правой стороны находится строка поиска, а также фильтры по начертанию, языку и стилю. Если вам нужен шрифт с обязательной поддержкой кириллицы, то в поле Languages (Языки) выбираем 
Выбрав подходящий шрифт, нажимаем на кнопку с плюсом, чтобы добавить его в коллекцию. В нижней части окна появится панель с указанием количества выбранных шрифтов. Нажимаем на кнопку справа, чтобы развернуть эту панель.
В правом верхнем углу панели наводим на кнопку со стрелкой вниз и выбираем Download (Загрузить).
В результате у нас скачается архив с выбранным шрифтом. Находим его на компьютере – Show in folder (Показать в папке).
Обратите внимание, что скриншот сделан в Google Chrome, в других браузерах интерфейс будет отличаться.
Как добавить шрифт в Фотошоп
Кликаем правой кнопкой по архиву и выбираем Извлечь в текущую папку или Извлечь в [название архива]. При выборе второго варианта появится отдельная папка, куда и поместится содержимое архива.
Левой кнопкой мышки дважды кликаем по файлу шрифта, чтобы открыть его в отдельном окне.
В открывшемся окне мы нажимаем кнопку Install (Установить) и готово! Теперь шрифт установлен!
Переходим в программу Photoshop, создаем новый документ или используем уже готовый. Активируем инструмент Type Tool (T) (Текст) и пишем нужный текст.
Активируем инструмент Type Tool (T) (Текст) и пишем нужный текст.
На панели Window – Character (Окно – Символ) в выпадающем списке находим установленный шрифт. Готово!
Из этого урока вы узнали, как установить шрифт в Фотошоп. Надеюсь, материал был для вас полезен. Если возникли вопросы, вы можете задать их внизу в комментариях или на страницах в социальных сетях ВКонтакте или Facebook. Также не забывайте подписываться на обновления сайта и делиться уроком с друзьями в социальных сетях. Приятного творчества!
Как добавить шрифты в Adobe Photoshop на Windows и Mac
Вы хотите использовать в своем дизайне шрифт, которого нет в Photoshop? К счастью, вы можете легко добавлять новые шрифты и использовать их в своих проектах Photoshop. Ваши недавно добавленные шрифты будут выглядеть и работать так же, как ваши существующие шрифты.
Независимо от того, используете ли вы Windows или macOS, мы рассказали, как импортировать и использовать новые шрифты в Adobe Photoshop на обеих платформах.
Как добавить шрифты в Adobe Photoshop в Windows
Windows использует универсальную систему шрифтов, в которой вы можете установить шрифт один раз и использовать его во всех своих приложениях. Это позволяет вам использовать установленные шрифты в Adobe Photoshop без каких-либо дополнительных действий.
Здесь мы рассмотрим, как вы можете загрузить, установить и использовать шрифт в Photoshop в Windows.
1. Загрузите и установите шрифт на свой компьютер.
Первое, что нужно сделать, это загрузить и установить шрифт в вашей системе Windows. Если вы это уже сделали, переходите к следующему разделу. Если вы еще не установили шрифт, закройте Photoshop на своем ПК и выполните следующие действия:
- Загрузите нужный шрифт и сохраните его на свой компьютер. Посетите некоторые из лучших веб-сайтов с бесплатными шрифтами, если вы не знаете, где их взять.
- Если вы скачали шрифт в виде ZIP-файла, извлеките содержимое архива в папку.
- Дважды щелкните извлеченный файл шрифта, и вы увидите предварительный просмотр шрифта.
- Нажмите « Установить» вверху, чтобы установить шрифт в вашей системе.
Шрифт сразу становится доступным для использования, не требуя перезагрузки компьютера.
2. Используйте загруженный шрифт в Adobe Photoshop.
Теперь, когда ваш шрифт установлен, вы можете использовать его в любом из ваших приложений, включая Photoshop.
Вот как это использовать в Photoshop:
- Откройте Photoshop и создайте новое изображение или откройте существующее.
- Щелкните значок T слева, чтобы открыть текстовый инструмент. Если вы не видите это меню, нажмите кнопку « Окно» вверху и выберите « Инструменты» .
- Щелкните раскрывающееся меню шрифтов вверху, и вы увидите все установленные шрифты.
- Выберите шрифт, который вы только что установили, и он будет доступен для использования на вашей фотографии.
- Используйте раскрывающееся меню рядом со шрифтами, чтобы стилизовать текст с помощью таких эффектов, как Light и Bold .

Как добавить шрифты в Adobe Photoshop на Mac
Adobe Photoshop работает на Mac практически так же, как и в Windows. Это означает, что вы можете установить шрифт, а затем использовать его в Photoshop.
Сделать это можно следующим образом.
1. Загрузите и установите шрифт на свой Mac.
Если вы еще этого не сделали, вам необходимо загрузить и установить шрифт на свой Mac, чтобы использовать его в Photoshop.
Вот как это сделать, если вы никогда не добавляли шрифт на свой Mac:
- Загрузите свой шрифт и извлеките содержимое архива шрифтов в папку.
- Дважды щелкните файл шрифта, и он откроется в Книге шрифтов.
- Предварительно просмотрите свой шрифт, а затем нажмите « Установить шрифт», чтобы установить шрифт на свой Mac.
2. Используйте загруженный шрифт в Adobe Photoshop.
Ваш установленный шрифт теперь готов к использованию в Photoshop, и вот как вы получаете к нему доступ:
- Откройте Photoshop и щелкните значок T (текстовый инструмент) слева.
- Выберите загруженный шрифт в раскрывающемся меню вверху.
- Если хотите, выберите вариант шрифта в меню рядом с названием шрифта.
- Начните печатать выбранным шрифтом.
Как установить новый шрифт в качестве шрифта по умолчанию в Adobe Photoshop
Вам не нужно много делать, чтобы установить новый добавленный шрифт в качестве шрифта по умолчанию в Photoshop. Просто откройте инструмент для текста, выберите новый шрифт, и этот шрифт станет основным шрифтом для инструмента.
В следующий раз, когда вы получите доступ к инструменту, выбранный вами шрифт будет предварительно выбран и готов для ввода текста.
Как удалить шрифты из Adobe Photoshop
Если вы установили слишком много шрифтов и вам сложно выбрать шрифт из меню шрифтов Photoshop, вы можете удалить некоторые из них. Это потребует от вас удаления шрифтов из вашей системы, потому что, как мы сказали ранее, Photoshop полагается на вашу систему для всех ваших шрифтов.
Если вы не хотите удалять шрифт навсегда, вы можете временно отключить его в своей системе.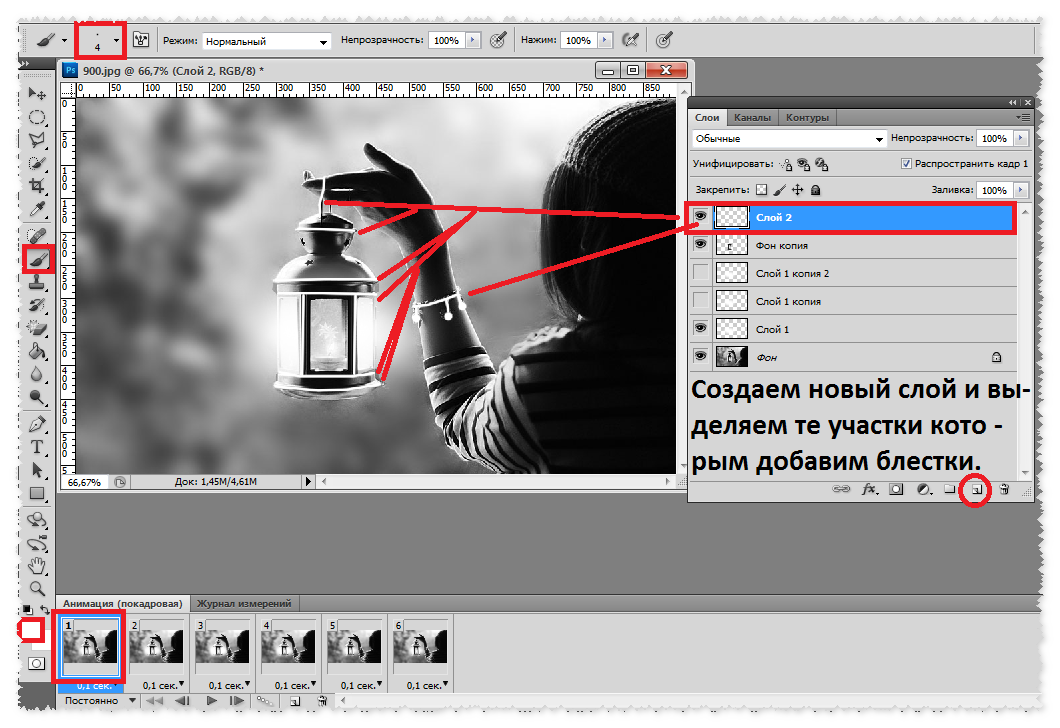 Это возможно с помощью бесплатного стороннего приложения в Windows, но Mac имеет эту функцию, встроенную в операционную систему.
Это возможно с помощью бесплатного стороннего приложения в Windows, но Mac имеет эту функцию, встроенную в операционную систему.
Вот как вы выполняете задачу.
1. Удалите шрифты из Adobe Photoshop на ПК.
Windows 10 позволяет удалять установленные шрифты из приложения «Настройки». Вот как:
- Откройте приложение « Настройки» и нажмите « Персонализация».
- Выберите Шрифты на левой боковой панели.
- Щелкните справа шрифт, который хотите удалить, и выберите « Удалить».
- В следующем окне еще раз выберите « Удалить» .
Если вы хотите только отключить шрифт, установите на свой компьютер бесплатное приложение FontBase . Это приложение работает как менеджер шрифтов и позволяет отключать шрифты, которые вы не хотите использовать. Когда вы снова будете готовы, вы можете включить свои шрифты, и они появятся в Photoshop.
2. Удалите шрифты из Adobe Photoshop на Mac.
Ваш Mac позволяет удалять шрифты, а также отключать шрифты без использования сторонних менеджеров шрифтов для вашего Mac .
Чтобы удалить шрифт с вашего Mac:
- Откройте утилиту Font Book предпочитаемым способом.
- Щелкните шрифт, который хотите удалить.
- Щелкните меню « Файл» вверху и выберите « Удалить» .
Чтобы временно отключить шрифт на Mac:
- Найдите свой шрифт в утилите Font Book.
- Щелкните шрифт правой кнопкой мыши и выберите « Отключить» .
- Нажмите Отключить в подсказке.
- Чтобы включить отключенный шрифт, щелкните его правой кнопкой мыши и выберите « Включить» .
Модернизация изображений с помощью новых шрифтов в Photoshop
Если вы не можете найти шрифт, который хотите использовать в своих проектах, или если вы создали свой собственный шрифт, описанные выше методы помогут вам добавить шрифты и сделать их пригодными для использования в Adobe Photoshop.
Более того, вы также можете использовать свои новые шрифты во многих других приложениях, включая Microsoft Word.
СвязанныйКак добавить шрифты в фотошоп —
Adobe Photoshop — наиболее часто используемый графический редактор, созданный экспертами по всему миру. Первоначально он был создан в 1988 году и с тех пор стал де-факто стандартом в сфере редактирования. Он поставляется с множеством настраиваемых параметров, которые позволяют пользователю отображать изображение любым удобным для него способом.
Варианты шрифтов в фотошопеОдна заметная опция, которая может понадобиться вам как графическому дизайнеру в Photoshop, — это шрифты. Поскольку в Photoshop уже есть все предопределенные шрифты Windows, вы можете подумать о том, как добавить дополнительные шрифты в пакет программного обеспечения. Ответ прост; просто установите шрифт на вашем Windows. Когда вы устанавливаете его в операционной системе, он автоматически загружается в Photoshop, и вы можете использовать его где угодно.
Замечания: Не все шрифты поддерживаются Photoshop. Если вы видите, что некоторые шрифты отображаются, но другие отсутствуют в меню выбора шрифтов в приложении, это, вероятно, означает, что они не поддерживаются (пока!) На платформе. Возможно, вам придется искать другие альтернативы.
Загрузка и установка шрифтов в WindowsКак упоминалось ранее, мы попытаемся загрузить шрифты на вашем компьютере с Windows. Программное обеспечение Photoshop автоматически выберет шрифты из системы и позволит вам выбирать их в любое время. Убедитесь, что у вас есть активное подключение к Интернету и права администратора.
- Перейдите на сайт шрифтов, откуда вы хотите скачать шрифт Загрузите шрифт в доступное место.
- Теперь дважды щелкните файл .tff (или любой другой формат), и когда появится новое окно, нажмите устанавливать Кнопка присутствует в верхней части экрана.

- После установки шрифта на компьютер нажмите Windows + S, введите ‘шрифт’В диалоговом окне и откройте соответствующую настройку системы.
- Зайдя в настройки шрифта, вы можете проверьте, установлен ли нужный шрифт или нет. В строке поиска введите название шрифта, который мы только что установили. Посмотрите, отображается ли это как запись. Если это так, это, вероятно, означает, что шрифт установлен и правильно включен в вашу систему.
- Вы можете нажать на шрифт для получения дополнительной информации, связанной с ним. Переместите ползунок в соответствии с вашими предпочтениями, чтобы выбрать для него нормальный размер. Если вы хотите удалить его в будущем, вы можете сделать это отсюда.
 Он имеет ссылку на перенаправление для магазина Microsoft, откуда вы можете установить шрифт напрямую, а не загружать его вручную и затем устанавливать.
Он имеет ссылку на перенаправление для магазина Microsoft, откуда вы можете установить шрифт напрямую, а не загружать его вручную и затем устанавливать.- Перейдите к Меню шрифтов как мы делали ранее и нажмите на Получите больше шрифтов в Microsoft Store.
- Теперь вы будете перенаправлены в магазин с открытой категорией шрифтов. Выберите шрифт, который вы хотите использовать, и установите его в магазине.
- Убедитесь, что вы перезагрузите компьютер а также Photoshop прежде чем пытаться изменить шрифт из приложения.
Создание уникального шрифта в Photoshop.
Для создания логотипа, либо фирменной надписи часто необходимо выгодно выделиться среди конкурентов. Для этого понадобится умение создавать уникальные шрифты в программе Photoshop.
Шаг 1. Открываем новый документ: Файл => Создать.
Открываем новый документ: Файл => Создать.
Шаг 2. Отрывается окно «Новый».
Пишем имя файла: «Мир».
Определяем ширину и высоту файла: 1920 и 1000 пикселей соответственно.
Разрешение: 300 пикселей на дюйм.
Содержимое фона: Белый.
Все остальные поля оставляем как и были, по умолчанию. Нажимаем «ОК».
Шаг 3. Видим белый лист. Выбираем инструмент «Горизонтальный текст», нажав правой кнопкой мыши на иконке текста «Т». В выпавшем меню нажимаем левой кнопкой мыши на инструменте «Горизонтальный текст».
Шаг 4. На белом листе левой кнопкой мыши рисуем прямоугольник, в котором появляется курсор.
Шаг 5. В верхней панели инструмента «Горизонтальный текст» выбираем:
— шрифт Arial,
— разновидность шрифта Black,
— размер шрифта 72 пикселя,
— цвет шрифта 4baa38 – зеленый.
Шаг 6.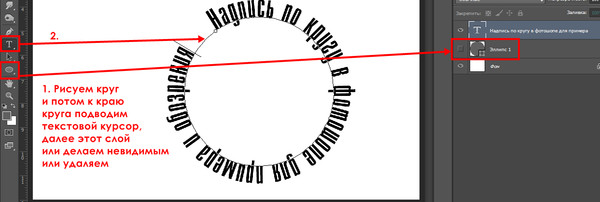 Пишем заглавными буквами: «МИР». В верхней панели находим галочку «Применить текущую правку» и нажимаем на нее.
Пишем заглавными буквами: «МИР». В верхней панели находим галочку «Применить текущую правку» и нажимаем на нее.
Шаг 7. Идем в панель «Слои», там находим слой с нашим текстом и кликаем на него правой кнопкой мыши.
Шаг 8. Открывается список, в котором мы выбираем «Преобразовать в кривые».
Шаг 9. Нажимаем комбинацию клавиш «Сtrl +». Нажимаем два раза, чтобы увеличить еще больше нашу надпись.
Шаг 10. Нажимаем клавишу «Пробел», и не отпуская, левой кнопкой мыши перемещаем изображение в удобную для нас сторону, чтобы все буквы были видны.
Шаг 11. В левой панели находим инструмент «Стрелка», выбираем его.
Шаг 12. Обводим прямоугольником часть буквы «И».
Шаг 13. Видим, что по контуру буквы «И» появились квадратные опорные точки. Те точки, которые были обведены и выделены инструментом «Стрелка» – черные, а все остальные прозрачные.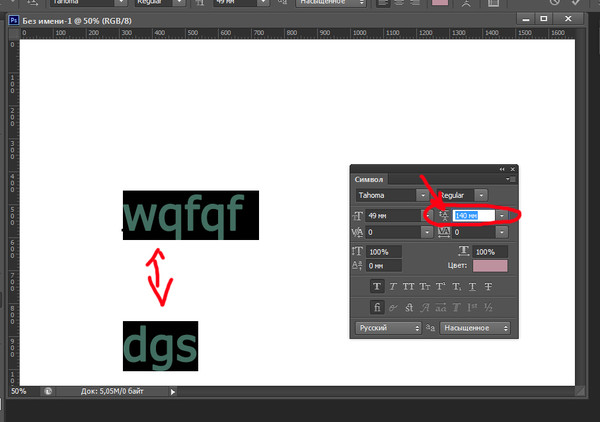
Шаг 14. Левой кнопкой мыши зажимаем верхнюю выделенную точку и тянем ее вправо. Вместе с ней передвигаются все выделенные точки.
Шаг 15. Видим результат.
Шаг 16. Для симметрии проделаем то же самое с другой стороны буквы «И» (шаги 11 — 15).
Шаг 17. Выбираем инструмент «Перо +» (добавить опорную точку).
Шаг 18. Левой кнопкой мыши ставим новую опорную точку на контуре в необходимом месте.
Шаг 19. Таким же путем ставим еще одну опорную точку.
Шаг 20. Выделяем левой кнопкой мыши угловую точку и нажимаем на клавиатуре «Delete».
Шаг 21. Смотрим, что точка удалена.
Шаг 22. Теперь нужно округлить срезанные края. Выделяем одну точку, нажимая левой кнопкой мыши на контуре в необходимом месте.
Шаг 23. Появляется прямая, проходящая сквозь выделенную точку. На концах этой прямой две круглые точки. Левой кнопкой зажимаем круглую точку, как показано на рисунке. И протягиваем немного вверх. Видим, что контур округлился.
На концах этой прямой две круглые точки. Левой кнопкой зажимаем круглую точку, как показано на рисунке. И протягиваем немного вверх. Видим, что контур округлился.
Шаг 24. Выделяем точку, и перемещаем ее при помощи левой кнопки мыши.
Шаг 25. Видим результат перемещения.
Шаг 26. Вновь появляется прямая, и за конец этой прямой тянем левой кнопкой мыши вверх, пока округлится контур так, как нам этого хочется, и чтоб было красиво.
Шаг 27. Таким образом, мы можем изменить каждый угол буквы «И», и она станет не похожа ни на одну другую. Вот что получилось у меня.
В этом уроке мы рассмотрели хороший метод сделать уникальную надпись. Обязательно нужно следить, чтобы буквы выглядели гармонично. Может быть и не обязательно, чтобы они были симметричными. Тут уж как подскажет Ваша фантазия. Желаем Вам творческих успехов и не забывайте писать комментарии снизу и делится уроками в социальных сетях.
как установить шрифт, добавить кисть, сменить язык и шпаргалка горячих клавиш / Фотообработка в Photoshop / Уроки фотографии
Дата публикации: 07.09.2017
При изучении новой программы наступает момент, когда хочется заглянуть в настройки и добавить что-то ещё. Мы расскажем об установках, к которым прибегают чаще всего. Также в конце статьи вы найдёте список горячих клавиш, то есть такие их сочетания, которые позволяют быстро управлять инструментами Photoshop и задавать команды.
Первым делом расскажем, как поменять язык в Фотошопе. Откройте программу, зайдите в пункт главного меню «Редактировать»/Edit, «Настройки»/Preference, «Интерфейс»/Interface.
В открывшемся диалоговом окне выбираем пункт «Интерфейс»/Interface, в выпадающем списке «Язык интерфейса»/Interface Language — нужный язык. Жмём Ok и перезапускаем программу.
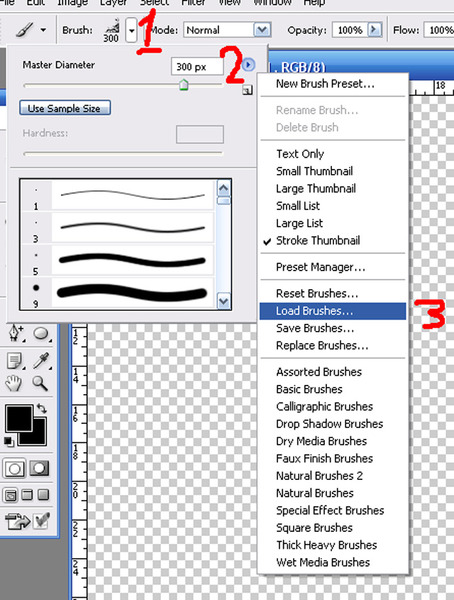
Следующей мы рассмотрим установку новых кистей. В Photoshop есть стандартный набор кистей, но к ним можно добавлять и другие. Сейчас на просторах интернета существуют очень интересные кисти, которые помогут дизайнеру воплотить необычные идеи.
В Photoshop есть стандартный набор кистей, но к ним можно добавлять и другие. Сейчас на просторах интернета существуют очень интересные кисти, которые помогут дизайнеру воплотить необычные идеи.
Допустим, вы скачали файл с новой кистью. Есть даже бесплатные файлы установок кистей, к примеру, кисть, которая рисует отпечатком «Лаванда».
Открываем Photoshop, заходим в «Редактирование»/Edit, «Наборы»/Presets, «Управление наборами»/Preset Manager.
В диалоговом окне жмём кнопку «Загрузить»/Load. Откроется проводник, как при обычном открытии любого файла. Далее остаётся указать путь к файлу кистей, который вы скачали, и нажать Ok. Окно «Управление наборами» закрываем кнопкой «Готово»/Done.
Теперь, выбрав инструмент «Кисть» (клавиша B), найдите ту, что мы закачали, и испытайте её.
Вот такие чудные отпечатки оставляет новая кисть.
Еще больше о Photoshop можно узнать на курсе «Photoshop. Базовые инструменты» в Fotoshkola.net .
Присоединять новые интересные шрифты тоже очень просто. Но добавлять их нужно в набор шрифтов вашей операционной системы, а не в Photoshop. При этом, как только вы добавите новый шрифт, он станет доступен Photoshop.
Скачайте шрифт на жёсткий диск вашего компьютера. Затем войдите в меню «Пуск» и в поисковой строке введите «Шрифт». Откройте папку «Шрифты» и просто скопируйте в неё файл с тем шрифтом, который вы до этого закачали.
Теперь, когда вы будете работать с текстом в Photoshop, просто найдите ваш шрифт по названию в списке шрифтов и используйте его при необходимости. В предыдущих статьях мы рассказывали, как работать с текстом в Photoshop.
Ну и напоследок — список горячих клавиш Photoshop.
Быстрые клавиши, наиболее часто используемые при работе
| CTRL+О | Открыть файл |
| CTRL+S | Сохранить файл |
| SHIFT+CTRL+S | Сохранить как… |
| CTRL+N | Новый файл |
| CTRL+W | Закрыть файл |
| CTRL+C | Копировать |
| CTRL+V | Вставить |
| CTRL+Z | Вернуть назад |
| CTRL+J | Копировать слой |
| CTRL+G | Создать группу слоёв |
| CTRL+E | Объединить слои |
| CTRL+L | Вызывает окно регулировки уровней для активного слоя |
| CTRL+Q | Выход из программы |
| CTRL+T | Свободная трансформация |
| CTRL+D | Снять выделение |
| CTRL+I | Инвертировать цвета |
| ALT+CTRL+Z | Вернуть на несколько шагов назад |
| SHIFT+CTRL+Z | Вернуть на шаг вперёд |
| CTRL (-) | Уменьшить изображение |
| CTRL (+) | Увеличить изображение |
| CTRL+0 | Во весь экран |
| ALT+CTRL+0 (ноль) | Натуральный размер изображения |
| CTRL+1 | Масштаб 100% |
| D | Установить цвета по умолчанию: основной цвет — чёрный, цвет фона — белый |
| X | Изменить цвета местами: меняются местами основной и цвет фона. |
| [ | Уменьшить размер кисти |
| ] | Увеличить размер кисти |
| CTRL+SHIFT+I | Инвертировать выделение |
| CTRL+SHIFT+X | Применить инструмент «Пластика» |
| ALT+BACKSPACE | Залить слой фоновым цветом |
| SHIFT+BACKSPACE | Залить слой основным цветом |
| SPACE | Удерживая клавишу, можно перемещаться по изображению, ухватившись мышью. Используется при крупном масштабировании, при необходимости перейти к другой части изображения |
Вы сделали ещё один шаг в изучении Photoshop. Не останавливайтесь на достигнутом, продолжайте обучение. Photoshop — удивительный инструмент. С ним вы воплотите любые творческие идеи.
Еще больше о Photoshop можно узнать на курсе «Photoshop. Базовые инструменты» в Fotoshkola.net .
Как установить в фотошоп плагины, шрифты, кисти, градиенты.
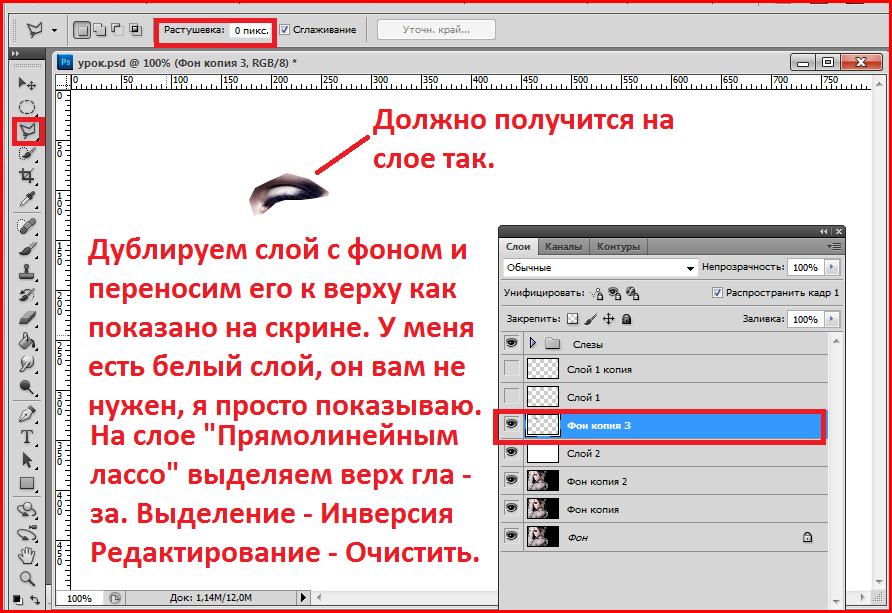
Как установить плагин в фотошоп.Плагины для фотошоп, это те же дополнительные фильтры для разных целей, качественно убрать шумы, для ретуши или для дизайнерских приемов, загнуть уголки слоя например, созданы облегчить работу дизайнера или фотографа. Бывают разные, посложнее и попроще.
Установка.
Если плагин посложнее, то обычно он требует установки и имеет установочный фаил с расширением exe, устанавливается как любая программа, часто прилагается инструкция. Устанавливаются плагины как правило в папку C:\Program Files\Adobe\Adobe Photoshop CS5\Plug-ins\, если установится непонятно куда, просто перетащите, что установилось в эту папку.
Плагин попроще, без всяких установок перетаскивается туда же — C:\Program Files\Adobe\Adobe Photoshop CS5\Plug-ins\Filters, только в зависимости от плагина в папки Filters или File-Formates и т.д.
При перезагрузке программы ими можно пользоваться. Появятся в панели Filters/Фильтры в самом низу.
Некоторые плагины, не работают в разных версиях программы. Например, плагин для CS2 может не работать в более новых версиях CS3 и выше.
Как установить градиенты в фотошоп.1. Скачиваете градиенты. Тип фаила градиент GRD. Устанавливаете (просто вставляете) в папку. C:\Program Files\Adobe\Adobe Photoshop CS5\Presets/Gradients
Потом, перезапустив фотошоп, открываете в программе вкладку градиенты, они появятся там и кликаете в списке нужные.
2. Второй способ установить градиенты.
Кликаете в панели меню Edit – Preset manager – в строке Preset type выбираете из списка Gradients, откроется окошко, ищем файл градиентов на своем компьютере, выбираем его и жмем Load (загрузить) . Загрузятся и появятся в списке.
Можно открыть Preset manager не через Edit… а др путем, через список градиентов как на скриншоте .
Как установить кисти в фотошоп.1.Установка кистей точно так же как и гарадиента . Берем скаченный фаил с кистями и вставляем в папку C:\Program Files\Adobe\Adobe Photoshop CS5\Presets/Brushes. Расширение фаила кисти – abr. После перезагрузки программы кисти появятся в списке. При выборе, вы можете набор кистей менять на другой нажав ОК ( тогда в пользовании будет только один конкретный набор) или добавлять к общим кистям в конец списка нажав Append. Потом сбрасывать по умолчанию если нужно. Reset brushes.
Берем скаченный фаил с кистями и вставляем в папку C:\Program Files\Adobe\Adobe Photoshop CS5\Presets/Brushes. Расширение фаила кисти – abr. После перезагрузки программы кисти появятся в списке. При выборе, вы можете набор кистей менять на другой нажав ОК ( тогда в пользовании будет только один конкретный набор) или добавлять к общим кистям в конец списка нажав Append. Потом сбрасывать по умолчанию если нужно. Reset brushes.
2.Второй способ добавить кисти. Так же как и градиенты через Preset manager. Edit – Preset manager – строка Preset Type выбираем из списка brushes. Загрузятся и появятся в списке.
Можно открыть Preset manager не через Edit… а др. путем, через список кистей как на рисунке.
Как установить шривты в фотошоп.Шрифты устанавливаются непосредственно на ваш компьютер через панель управления, не в программу фотошоп. Потом они будут доступны в других программах использующих шрифты. Таких как Word например.
Кликаете: Пуск – Настройка – Панель управления – Папка Шрифты. Переносите файлик со шрифтами туда.
Переносите файлик со шрифтами туда.
КАК ДОБАВИТЬ ШРИФТЫ В PHOTOSHOP — НАПРАВЛЯЮЩИЕ
Направляющие 2021
Adobe Photohop — самый используемый графический редактор экспертами со всего мира. Первоначально он был создан в 1988 году и с тех пор стал «де-факто» стандартом в индустрии редактирования.
Содержание:
Adobe Photoshop — самый используемый графический редактор экспертами со всего мира. Первоначально он был создан в 1988 году и с тех пор стал «де-факто» стандартом в индустрии редактирования. Он поставляется с множеством настраиваемых параметров, которые позволяют пользователю визуализировать изображение так, как он хочет.
Один из заметных вариантов, который может вам понадобиться как графический дизайнер в Photoshop, — это шрифты. Поскольку в Photoshop уже есть все предопределенные шрифты Windows, вы, возможно, ищете, как добавить дополнительные шрифты в программный пакет. Ответ прост; просто установите шрифт в Windows. Когда вы устанавливаете его в операционной системе, он автоматически выбирается Photoshop, и вы можете использовать его где угодно.
Примечание: Не все шрифты поддерживаются Photoshop. Если вы видите, что некоторые шрифты отображаются, а другие отсутствуют в меню выбора шрифтов в приложении, это, вероятно, означает, что они не поддерживаются (пока!) На платформе. Возможно, вам придется поискать другие альтернативы.
Скачивание и установка шрифтов в WindowsКак упоминалось ранее, мы попробуем загрузить шрифты на ваш компьютер с Windows. Программа Photoshop автоматически подберет шрифты из системы и позволит вам выбрать их, когда захотите. Убедитесь, что у вас есть активное подключение к Интернету и права администратора.
- Перейдите на сайт шрифтов, откуда вы хотите скачать шрифт. Загрузите шрифт в доступное место.
- Теперь дважды щелкните файл .tff (или любой формат) и, когда появится новое окно, щелкните значок установить кнопка присутствует в верхней части экрана.
- После установки шрифта на компьютер нажмите Windows + S, введите ‘шрифт’В диалоговом окне и откройте соответствующую настройку системы.

- В настройках шрифта вы можете проверьте, установлен ли желаемый шрифт или не. В строке поиска введите название только что установленного шрифта. Посмотрите, отображается ли он как запись. Если это так, это, вероятно, означает, что шрифт установлен и встроен в вашу систему правильно.
- Вы можете щелкнуть шрифт для получения дополнительной информации о нем. Переместите ползунок в соответствии с вашими предпочтениями, чтобы выбрать для него нормальный размер. Если вы хотите удалить его в будущем, вы можете сделать это здесь.
Если вы хотите установить шрифты прямо из магазина Windows, вы можете сделать это из главного меню шрифта. У него есть ссылка перенаправления для магазина Microsoft, откуда вы можете установить шрифт напрямую, а не загружать вручную, а затем устанавливать.
- Перейдите к Меню шрифтов как мы делали раньше и нажмите Получите больше шрифтов в Microsoft Store.
- Теперь вы будете перенаправлены в магазин с открытой категорией шрифтов.
 Выберите шрифт, который хотите использовать, и установите его из магазина.
Выберите шрифт, который хотите использовать, и установите его из магазина.
- Убедитесь, что вы перезагрузите компьютер и Фотошоп перед попыткой изменить шрифт из приложения.
Настройте рыбную раковину на Mac — шаг за шагом | Туан Нгуен | Tuan Nguyen
fish shell — одна из самых популярных оболочек для терминалов в Mac и Linux. Он также доступен в Windows 10 с появлением подсистемы Windows для Linux (WSL). Моя любимая особенность рыбной раковины — автоматическое предложение.
В этом посте я пошагово расскажу, как настроить его на Mac. Большинство шагов выполняется в Терминале, поэтому сначала откройте его.
Шаг 1. Установите homebrew
/ usr / bin / ruby -e «$ (curl -fsSL https: // raw.githubusercontent.com/Homebrew/install/master/install) "
Шаг 2 — Установите рыбий панцирь
brew install fish
Шаг 3 — Добавьте рыбный панцирь
echo" / usr / local / bin / fish "| sudo tee -a / etc / shells
Шаг 4 — Сделайте рыбий панцирь оболочкой по умолчанию для Терминала
chsh -s / usr / local / bin / fishТолько рыбная оболочка
скучна. С помощью Oh My Fish вы можете сделать оболочку более красочный и, что самое главное, он может помочь вам работать более продуктивно.
С помощью Oh My Fish вы можете сделать оболочку более красочный и, что самое главное, он может помочь вам работать более продуктивно.
Шаг 5 — Установите Oh My Fish
curl -L https://get.oh-my.fish | fish
Шаг 6 — Установите тему bob the fish и шрифт ботаника
omf install bobthefish
brew tap caskroom / fonts
brew cask install font-firacode-nerd-font
set -U theme_nerd_fonts да
Шаг 7 — Изменить схему темы
Создайте файл config.fish в ~ / .config / fish, затем добавьте в файл
set theme_color_scheme gruvbox
. Вы можете найти больше о схемах рыбалки в документации.
Шаг 8 — Настройте шрифт для терминала
Откройте настройки терминала
Нажмите «Изменить»… затем выберите FuraCode Nerd Font, как показано на скриншоте.
Вы можете настроить тему панциря рыбы и рыбки, используя документ здесь и здесь.
fish shell предоставляет веб-интерфейс для настройки. С помощью этого интерфейса вы можете выбрать тему для установки для Терминала из одной из предопределенных тем или определить свою собственную тему.
Он также позволяет изменять стиль подсказки, просматривать функции, переменные и многое другое.Вы можете открыть веб-интерфейс с помощью этой команды в Терминале
fish_config
Вот моя рыбная раковина после завершения настройки
Если вы являетесь пользователем Visual Studio Code, вы можете настроить встроенный терминал Visual Studio Code чтобы использовать рыбий панцирь, выполнив этот дополнительный шаг.
Дополнительный шаг — настройте код Visual Studio для использования рыбной оболочки
Откройте настройки кода Visual Studio и добавьте эти строки в
// в настройках.json
«terminal.integrated.shell.osx»: «/ usr / local / bin / fish»,
«terminal.integrated.fontSize»: 14,
«terminal.integrated.fontFamily»: «FuraCode Nerd Font»
Справочная информация и документация
Установите шрифты Nerd для добавления символов в код в Linux
В этом кратком руководстве объясняется, что такое проект Nerd Fonts, как установить шрифты Nerd в Linux и как добавлять глифы (значки и символы) в код или просто распечатайте значки в оболочке с помощью шрифтов Nerd Fonts.
Nerd Fonts — Исправленные шрифты, предназначенные для разработчиков.
Nerd Fonts — это проект по созданию исправленных шрифтов. Патченный шрифт — это шрифт, в который вставлен набор значков. Nerd Fonts использует популярные программные шрифты и добавляет к ним большое количество глифов (значков). Глифы добавляются из популярных знаковых шрифтов, таких как Font Awesome, Devicons, Font Logos, Material Design Icons, Powerline Symbols, Octicons, Weather Icons и многих других.
Nerd Fonts в настоящее время включает более 50 исправленных и готовых к использованию лучших шрифтов для разработчиков.Все исправленные шрифты содержат более 3600 значков и символов, объединенных из популярных наборов значков. В проекте Nerd Fonts также есть сценарий Font Patcher , который позволяет вам создавать собственные настраиваемые исправленные шрифты. Это бесплатный проект с открытым исходным кодом, размещенный на GitHub.
Установка шрифтов Nerd в Linux
Установка шрифтов Nerd аналогична установке шрифтов в Linux. Загрузите предпочитаемый шрифт nerd с официальной страницы загрузки Nerd Fonts . Извлеките загруженный zip-файл и скопируйте шрифты в папку
Загрузите предпочитаемый шрифт nerd с официальной страницы загрузки Nerd Fonts . Извлеките загруженный zip-файл и скопируйте шрифты в папку fonts вашей системы.Расположение папки со шрифтами зависит от используемого вами дистрибутива Linux.
В системах на основе Debian, таких как Ubuntu и его производные, скопируйте файлы шрифтов в папку / usr / share / fonts / или / usr / local / share / fonts / для установки шрифтов для всех пользователей. т.е. для всей системы . Если вы хотите установить шрифты для определенного пользователя, скопируйте шрифты в папку ~ / .local / share / fonts / . Я хотел установить шрифты только для моей текущей учетной записи пользователя, поэтому я скопировал файлы шрифтов в ~ /.локальный / share / fonts / каталог. Расположение шрифтов
Вы также можете сделать это из командной строки, как показано ниже. Используйте
Используйте wget или curl для загрузки файлов шрифтов. Распакуйте zip-файл, используя unzip , а затем скопируйте файлы шрифтов в каталог fonts , используя команды cp или mv .
$ wget https://github.com/ryanoasis/nerd-fonts/releases/download/v2.1.0/Hermit.zip $ распаковать Hermit.zip $ cp ~ / Downloads / Hermit / Hurmit * .otf ~ / .local / share / fonts / Если у вас много шрифтов, вы можете использовать подкаталоги для организации коллекции шрифтов.
Шрифты Nerd также упакованы для Arch Linux и доступны в AUR . Установите любой шрифт ботаника с помощью вспомогательной программы AUR, например Yay , как показано ниже:
$ yay -S nerd-fonts-hermit После копирования или установки шрифтов выполните следующую команду для создания кэша информации о шрифтах. файлы для приложений, использующих
файлы для приложений, использующих fontconfig для обработки шрифтов.:
$ fc-cache -fv Пример вывода:
/ usr / share / fonts / type1: кэширование, новое содержимое кеша: 0 шрифтов, 2 директории
/ usr / share / fonts / type1 / gsfonts: кеширование, новое содержимое кеша: 35 шрифтов, 0 директорий
/ usr / share / fonts / type1 / urw-base35: кеширование, новое содержимое кеша: 35 шрифтов, 0 директорий
/ usr / local / share / fonts: кеширование, новое содержимое кеша: 0 шрифтов, 0 каталогов
/home/sk/.local/share/fonts: кеширование, новое содержимое кеша: 68 шрифтов, 0 директорий
[...] Создайте файлы кэша информации о шрифтах с помощью команды fc-cache Аналогичным образом загрузите другие шрифты и переместите их все в системный каталог fonts и обновите кеш шрифтов.
Проверьте, добавлен ли конкретный шрифт из командной строки, используя команды ls и grep :
$ ls ~ / . local / share / fonts / | grep Hurmit
local / share / fonts / | grep Hurmit Пример вывода:
Hurmit Bold Nerd Font Complete Mono.otf
Hurmit Bold Nerd Font Complete Mono для Windows Compatible.otf
Шрифт Hurmit Bold Nerd Complete.otf
Шрифт Hurmit Bold Nerd Complete Windows Compatible.otf
Шрифт Hurmit Light Nerd Complete Mono.otf
Hurmit Light Nerd Font Complete Mono Windows Compatible.otf
Шрифт Hurmit Light Nerd Complete.otf
Шрифт Hurmit Light Nerd Полный Windows Compatible.otf
Шрифт Hurmit Medium Nerd Complete Mono.otf
Hurmit Medium Nerd Font Complete Mono для Windows Compatible.otf
Шрифт Hurmit Medium Nerd Complete.otf
Hurmit Medium Nerd Font Complete Windows Compatible.otf Перечислите все доступные шрифты в вашей системе с помощью команды:
$ fc-list Добавьте символы в свой код с помощью шрифтов Nerd
Как только шрифты Nerd будут добавлены в ваш system, вы можете использовать их буквально в любом месте вашей системы. Я пробовал шрифты Nerd в Deepin Terminal, GNOME terminal, gedit и Gimp. Все работало нормально, и я могу добавлять различные типы значков и символов в текст и код.
Я пробовал шрифты Nerd в Deepin Terminal, GNOME terminal, gedit и Gimp. Все работало нормально, и я могу добавлять различные типы значков и символов в текст и код.
Перейдите к шпаргалке Nerd Fonts , где вы можете найти множество значков и символов и выбрать значок, который хотите использовать. Для быстрого поиска определенного значка или символа доступна панель поиска. Чтобы отобразить все доступные наборы значков, поместите курсор мыши в строку поиска и нажмите ENTER.
Шпаргалка по шрифтам Nerd FontsЧтобы скопировать значок или символ, просто наведите на него указатель мыши и нажмите «Значок», «Класс» или «Шестнадцатеричный код», чтобы скопировать его.
Скопируйте значки и символы из шпаргалки Nerd FontsВставьте скопированный значок в любое место.
Вы также можете скопировать класс и вставить код в свой код CSS или HTML . Вот два примера для справки.
Я действительно Я использую кстати.
Печать значков и символов в оболочке с использованием скриптов Nerd Fonts
Если вы не хотите копировать глифы с веб-страницы шпаргалки Nerd Fonts, используйте скрипты Nerd Fonts для прямой печати значков / символов в вашей оболочке, а затем скопируйте их в свой код или куда хотите.
Загрузите предоставленные сценарии здесь и сохраните их в каталоге ~ / .local / share / fonts / . Я собираюсь загрузить Font Linux icons с помощью команды:
$ wget https://raw.githubusercontent.com/ryanoasis/nerd-fonts/master/bin/scripts/lib/i_linux.sh -P ~ /. local / share / fonts / Источник скрипта загрузки:
$ source ~ / .local / share / fonts / i_linux.sh Проверьте, можете ли вы распечатать значки в Терминале с помощью любого из следующие команды:
$ echo $ i_linux_archlinux $ echo $ i_linux_centos $ echo $ i_linux_debian $ echo $ i_linux_fedora _95000 Оболочка с использованием скриптов Nerd FontsКак уже говорилось, в настоящее время доступно более 50 исправленных шрифтов.
Если ваш любимый шрифт еще не исправлен, вы можете исправить его с помощью сценария Font Patcher , созданного автором Nerd Fonts. Для получения более подробной информации обратитесь к ссылкам на проекты, приведенным ниже.
Ресурс:
Связанное чтение:
Fish and iTerm2
Итак, от скуки я решил обновить свою оболочку и терминал до чего-то ближе к 2017 году, вместо того, чтобы жить в начале 90-х. Ясно, что все эти годы я использовал
bash- в основном на Ubuntu, а в последнее время и на OSX.Но я всегда был ленивым и самодовольным с терминалом. Я всегда хотел установитьрыбок- Friendly Interactive SHell . за интеграцию с git и очень богатое взаимодействие. Конечно, все это можно сделать наbashилиzsh, но я ненавижу конфигурацию и прочесал сотни репозиториев git дляbashfilesи нашел то, что мне подходит.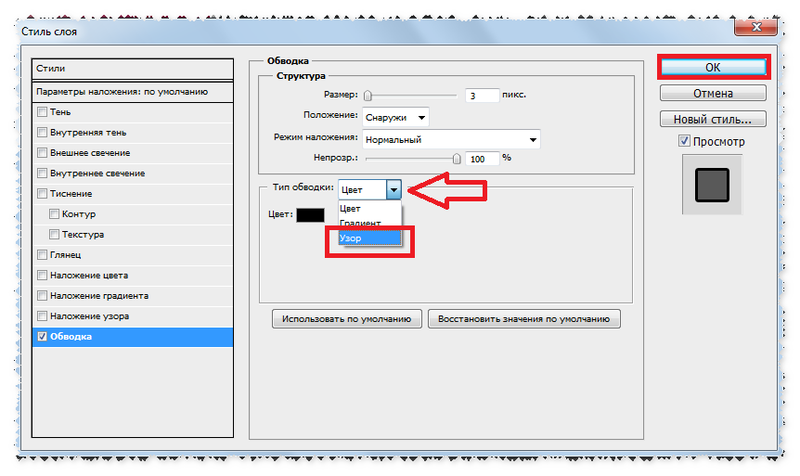
В то время как на
рыбал, я также решил обновить терминал Macпо умолчаниюдоiTerm2.Это привело меня к пути от установки шрифтов до выбора темы, которая мне подходит. Но опять же, здесь нет настроек, с которыми можно было бы связываться.Установка рыбки
Так как я заварил, я смог просто сделать это
bash-3.2 $ brew установить рыбуЕсли у вас нет напитка, перейдите на сайт fishshell.com, чтобы получить инструкции по его настройке. У них есть MacPorts, установщик и исполняемый файл.
После установки тема по умолчанию поддерживает репозитории git, в которых подсказка указывает состояние локального репозитория, имеет красивую подсветку синтаксиса в командной строке и типичные вещи, которые вы ожидаете от оболочки 21 века.
Вы можете увидеть изменение подсказки, а также отметку времени, отображаемую справа от окна.
Если вы хотите сделать Fish своей оболочкой по умолчанию, добавьте
/ usr / local / bin / fishв самый верх/ etc / shellsи выполнитеchsh -s / usr / local / bin / fish.Если нет, то вы всегда можете ввести
fishвbash.Установка omf
Учитывая богатство рыбных тем и плагинов, лучше всего использовать
omf- Oh My Fish, который является более или менее менеджером пакетов для рыбы.Для установки
omf-bash-3.2 $ curl -L https://get.oh-my.fish | рыбыПосле установки
omfпроверка тем и т. Д. Становится проще простого. Для этого введите в командной строкеomf, чтобы просмотреть параметры. При вводеomf themeотобразится большой список, и чтобы увидеть, как выглядят эти темы, перейдите сюда, чтобы просмотреть их.Мне понравился
bobthefish, и установил вот так -⋊> ~ / work omf install bobthefish 05:04:17 Обновление https: // github.com / oh-my-fish / packages-main master ... Готово! Установка пакета bobthefish ✔ bobthefish успешно установлен.~ / work 773ms сб, 8 апр, 05:07:06 2017
Вы всегда можете вернуться к
по умолчанию, набравomf theme default. Вы можете установить множество тем и переключаться между ними, пока не освоитесь с одной из них.Однако в этой теме (и во многих других) используются шрифты, которые необходимо установить.
Установка исправленных шрифтов Powerline
~ / работа git clone https://github.com/powerline/fonts.git ~ / work cd шрифты ~ / w / fonts master ./install.sh Копирование шрифтов ... Шрифты Powerline установлены в / Users / mpandit / Library / FontsНе стесняйтесь удалить
шрифтов из каталога.Установка iTerm2
Скачал и установил iTerm2, что очень просто сделать.
Взгляните на Книгу шрифтов и выберите нужный шрифт Powerline.Мне нравится
Ubuntu Mono. Вы можете ввестиpowerlineв небольшое текстовое поле поиска в Книге шрифтов, чтобы сократить список.После выбора установите шрифт здесь -
Перезапустите iTerm2, и все будет готово!
Интеграция с Github
На этом изображении показано, как изменяется приглашение, когда мы вносим простые изменения в локальный репозиторий git. Я использую тему
bobthefish. См. Подробности темы о том, как подсказка указывает различные состояния, такие как локально зафиксированные, но не отправленные изменения и т. Д.Как видите, он очень полезен, без какой-либо настройки для этого. Для меня это одна из самых полезных и мощных функций
fish.Теперь, когда у вас настроено
fishиomf, поиграйте с множеством опций, и если вы никогда не использовали его раньше, вы будете удивлены, насколько современная и удобная для разработчиков эта настройка. Глубина автозаполнения, выходящая за рамки только имен файлов, автопредложений, навигации по истории и раскраски синтаксиса, делает работу в терминале такой продуктивной и безболезненной!Наконец, оболочка командной строки для рыбьей оболочки 90-х годов
fish - это умная и удобная оболочка
для командной строки для Linux, macOS и всего остального семейства.Научи меня ловить рыбу
Руководство Документация Часто задаваемые вопросы БлогПоймай рыбу
Установщик
10.9+, Intel or Apple Silicone
Устанавливается в / usr / local /Приложение
10.9+, кремний Intel или Apple
Установка не требуетсяfish.app связывает рыбную оболочку с AppleScript, который запускает ее в Терминале.
Ничего не установлено.Cygwin
рыба доступна в установке , ,
в категории Раковины.fish-3.2.2.tar.xz
cmake.; делать; sudo make install
Размер файла: 6.2 МБ
SHA1: a30b2d21ebec63a00282181b8660224ce71edbad
Мастер Git
git clone https: // github.com / fish-shell / fish-shell.git
cd fish-shell; cmake.; делать; sudo make install
(Новейшая установка, для разработчиков и опытных пользователей.)История выпусков
Информация о версии
- 3.2.2, выпущен 7 апреля 2021 г.

- 3.2.1, выпущена 18 марта 2021 г. (архив)
- 3.2.0, выпущенный 1 марта 2021 г. (архив)
- 3.1.2, выпущенная 29 апреля 2020 г. (архив)
- 3.1.1, выпущенная 27 апреля 2020 г. (архив)
- 3.1.0, выпущенная 12 февраля 2020 г. (архив)
- 3.0.2, выпущен 19 февраля 2019 г. (архив)
- 3.0.1, выпущена 11 февраля 2019 г. (архив)
- 3.0.0, выпущенный 28 декабря 2018 г. (архив)
- 2.7.1, выпущен 22 декабря 2017 г. (архив)
- 2.
 7.0, выпущен 23 ноября 2017 г. (архив)
7.0, выпущен 23 ноября 2017 г. (архив) - 2.6.0, выпущен 3 июня 2017 г. (архив)
- 2.5.0, выпущенная 3 февраля 2017 г. (архив)
- 2.4.0, выпущен 8 ноября 2016 г. (архив)
- 2.3.1, выпущен 3 июля 2016 г. (архив)
- 2.3.0, выпущен 20 мая 2016 г. (архив)
- 2.2.0, выпущен 12 июля 2015 г. (архив)
- 2.1.2, выпущенный 27 февраля 2015 г. (архив)
- 2.1.1, выпущена 26 сентября 2014 г. (архив - обратите внимание, что в macOS есть известные проблемы)
- 2.
 1.0, выпущен 1 ноября 2013 г. (архив
- обратите внимание, что есть известные уязвимости безопасности)
1.0, выпущен 1 ноября 2013 г. (архив
- обратите внимание, что есть известные уязвимости безопасности)
Развитие
Разработка fish размещена на GitHub.Чтобы клонировать репозиторий git:git clone https://github.com/fish-shell/fish-shell.git
Инструкции по сборке представлены на внизу страницы GitHub.Нужна помощь?
границ | Эффективность одного фолликулостимулирующего гормона (ФСГ), ФСГ + лютеинизирующего гормона, менопаузального гонадотропина человека или ФСГ + хорионического гонадотропина человека на результаты вспомогательных репродуктивных технологий в эпоху «персонализированной» медицины: метаанализ
Введение
Лютеинизирующий гормон (ЛГ) и хорионический гонадотропин человека (ХГЧ) представляют собой гетеродимерные гликопротеиновые гормоны, действующие на один и тот же рецептор (LHCGR) (1).Эти гонадотропины долгое время считались эквивалентными на молекулярном уровне, пока не была продемонстрирована специфическая внутриклеточная передача сигналов (2). In vitro модели клеток гранулезы человека продемонстрировали, что ХГЧ более эффективен, чем ЛГ в индукции продукции циклического аденозинмонофосфата (цАМФ) (2), в то время как последний приводит к преимущественной активации путей ERK1 / 2 и AKT (2). Таким образом, хотя ЛГ и ХГЧ активируют разную кинетику (2, 3), остается неясным, влияют ли они по-разному на in vivo и как они по-разному (4).
In vitro модели клеток гранулезы человека продемонстрировали, что ХГЧ более эффективен, чем ЛГ в индукции продукции циклического аденозинмонофосфата (цАМФ) (2), в то время как последний приводит к преимущественной активации путей ERK1 / 2 и AKT (2). Таким образом, хотя ЛГ и ХГЧ активируют разную кинетику (2, 3), остается неясным, влияют ли они по-разному на in vivo и как они по-разному (4).
У человека фолликулостимулирующий гормон (ФСГ) и ЛГ действуют согласованно, стимулируя фолликулогенез и овуляцию. Следовательно, эти гонадотропины используются в контролируемой стимуляции яичников (COS) для получения относительно высокого количества ооцитов, которые можно использовать в свежем виде или после криоконсервации (5) для обеспечения беременности. Врач определяет предположительно наиболее подходящий режим с точки зрения протокола аналога гонадотропин-рилизинг-гормона (ГнРГ), состава ФСГ, начальной дозы ФСГ и комбинации различных гонадотропинов после оценки профилей демографического, антропометрического и яичникового резерва (6– 8). Обычно в качестве стандартного лечения выбирают ФСГ, и можно добавлять ХГЧ или ЛГ. Знания физиологии человека служат обоснованием для добавления активности ЛГ во время COS. Хотя in vitro, и модели на животных предоставили доказательства гормоноспецифического действия, выбор оптимальной комбинации гонадотропинов для использования при COS недостаточно стандартизован и остается доверено решению клинициста. В частности, гормон беременности ХГЧ обычно используется для получения ЛГ-подобной активности и поддержки роста нескольких фолликулов на протяжении десятилетий (9).Имея это в виду, менопаузальный гонадотропин человека (чМГ) обычно используется в качестве препарата с LH-подобной активностью из-за присутствия молекул LH и / или hCG. Неоднократно предлагались только чМГ и ХГЧ / ЛГ + ФСГ (10, 11), но некоторые неблагоприятные результаты, в частности, с точки зрения количества извлеченных ооцитов (12, 13), вызывали опасения относительно полезности добавления «активности ЛГ».
Обычно в качестве стандартного лечения выбирают ФСГ, и можно добавлять ХГЧ или ЛГ. Знания физиологии человека служат обоснованием для добавления активности ЛГ во время COS. Хотя in vitro, и модели на животных предоставили доказательства гормоноспецифического действия, выбор оптимальной комбинации гонадотропинов для использования при COS недостаточно стандартизован и остается доверено решению клинициста. В частности, гормон беременности ХГЧ обычно используется для получения ЛГ-подобной активности и поддержки роста нескольких фолликулов на протяжении десятилетий (9).Имея это в виду, менопаузальный гонадотропин человека (чМГ) обычно используется в качестве препарата с LH-подобной активностью из-за присутствия молекул LH и / или hCG. Неоднократно предлагались только чМГ и ХГЧ / ЛГ + ФСГ (10, 11), но некоторые неблагоприятные результаты, в частности, с точки зрения количества извлеченных ооцитов (12, 13), вызывали опасения относительно полезности добавления «активности ЛГ».
В настоящее время рынок гонадотропинов предлагает широкий выбор, включая мочевые и рекомбинантные препараты ФСГ, ЛГ, ХГЧ и чМГ по отдельности или в различных комбинациях, недавно дополнительно обогащенных биоаналогами.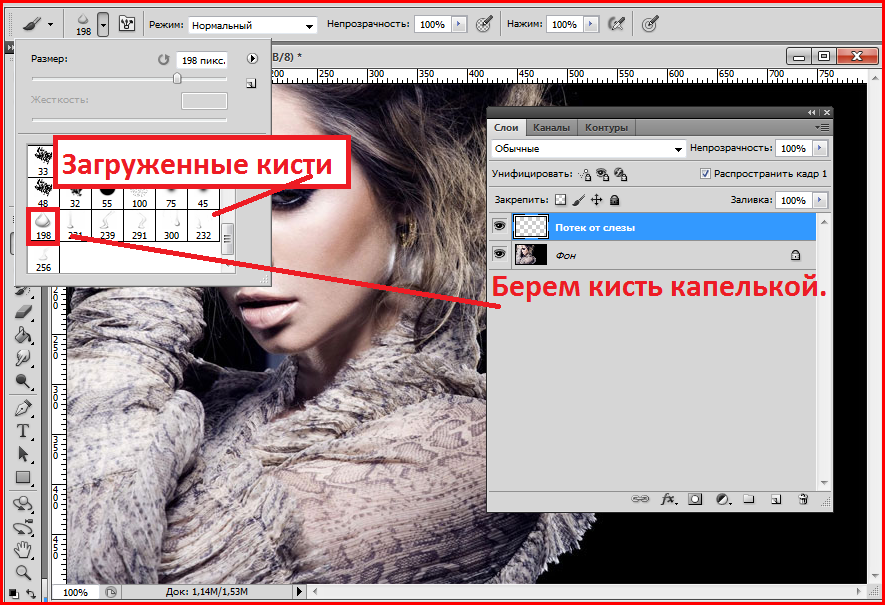 Эта палитра конкурирующих препаратов, зарегистрированных по одним и тем же показаниям, но биохимически и физиологически различающихся, ввела концепцию «персонализированных» схем вспомогательных репродуктивных технологий (ВРТ), которая очень привлекательна для пациентов и врачей, но не подкреплена убедительными доказательствами и в значительной степени отраслевыми. повышен. Эти гонадотропины демонстрируют различную кинетику в моделях in vitro и , но до сих пор нет четких различий in vivo в COS. В большинстве исследований пытались ответить на вопрос о том, какие комбинации гонадотропинов являются лучшими, хотя были достигнуты неубедительные результаты, которых недостаточно для того, чтобы сделать действительно обоснованный и персонализированный выбор АРТ.Действительно, до сих пор нет мощных, правильно спланированных контролируемых проспективных клинических испытаний, подтверждающих обоснование какой-либо схемы COS. На самом деле, дизайн рандомизированных клинических испытаний в этих условиях является сложной задачей из-за специфической эмоциональной ситуации и неоднородности бесплодной популяции, а также требуемых времени и затрат.
Эта палитра конкурирующих препаратов, зарегистрированных по одним и тем же показаниям, но биохимически и физиологически различающихся, ввела концепцию «персонализированных» схем вспомогательных репродуктивных технологий (ВРТ), которая очень привлекательна для пациентов и врачей, но не подкреплена убедительными доказательствами и в значительной степени отраслевыми. повышен. Эти гонадотропины демонстрируют различную кинетику в моделях in vitro и , но до сих пор нет четких различий in vivo в COS. В большинстве исследований пытались ответить на вопрос о том, какие комбинации гонадотропинов являются лучшими, хотя были достигнуты неубедительные результаты, которых недостаточно для того, чтобы сделать действительно обоснованный и персонализированный выбор АРТ.Действительно, до сих пор нет мощных, правильно спланированных контролируемых проспективных клинических испытаний, подтверждающих обоснование какой-либо схемы COS. На самом деле, дизайн рандомизированных клинических испытаний в этих условиях является сложной задачей из-за специфической эмоциональной ситуации и неоднородности бесплодной популяции, а также требуемых времени и затрат. Таким образом, было опубликовано 64 метаанализа для сравнения различных подходов и результатов АРТ (таблица 1). Однако каждый обзор ориентирован на отдельное сравнение (например,g., чМГ против ФСГ, агонист ГнРГ против антагонистов и т. д.) в специфических клинических условиях. В частности, в 25 систематических обзорах сравнивалась эффективность различных аналогов ГнРГ, в 17 сравнивалась моча и препараты рекомбинантного ФСГ, и только в 6 оценивалась эффективность добавления ЛГ к ФСГ (таблица 1). Ни одно из этих сравнений не обеспечило всестороннего анализа всего процесса, от набора ооцитов до уровня живорождения, и их выводы редко используются в клинической практике. Фактически, не существует общепринятых рекомендаций в этой области медицины, в которых зарегистрированные показания и возмещение гонадотропинов национальными системами здравоохранения основываются на затратах, а не на научных данных / клинических результатах.
Таким образом, было опубликовано 64 метаанализа для сравнения различных подходов и результатов АРТ (таблица 1). Однако каждый обзор ориентирован на отдельное сравнение (например,g., чМГ против ФСГ, агонист ГнРГ против антагонистов и т. д.) в специфических клинических условиях. В частности, в 25 систематических обзорах сравнивалась эффективность различных аналогов ГнРГ, в 17 сравнивалась моча и препараты рекомбинантного ФСГ, и только в 6 оценивалась эффективность добавления ЛГ к ФСГ (таблица 1). Ни одно из этих сравнений не обеспечило всестороннего анализа всего процесса, от набора ооцитов до уровня живорождения, и их выводы редко используются в клинической практике. Фактически, не существует общепринятых рекомендаций в этой области медицины, в которых зарегистрированные показания и возмещение гонадотропинов национальными системами здравоохранения основываются на затратах, а не на научных данных / клинических результатах.
Таблица 1. Предыдущие характеристики метаанализа .
Имея в виду физиологию и различные эффекты in vitro ЛГ и ХГЧ, в этой работе мы рассмотрели вопрос о том, могут ли ЛГ, ЛГ-подобная активность и ХГЧ иметь разные результаты в отношении результатов COS. С этой целью мы оценили эффективность ЛГ или ХГЧ плюс ФСГ или только чМГ по сравнению с тем, что считается стандартным лечением COS, то есть использованием только ФСГ, используя метааналитический подход.Это первый метаанализ, в котором рассматриваются все комбинации гонадотропинов. Кроме того, предоставляется полная оценка всех конечных точек АРТ, чтобы распознать, когда и как ЛГ, активность ЛГ и ХГЧ влияют на результаты АРТ.
Материалы и методы
Мы выполнили метаанализ в соответствии с положениями Cochrane Collaboration и PRISMA. Метаанализ был включен в Международный проспективный реестр систематических обзоров (PROSPERO; регистрационный номер CRD42016048404) до начала исследования, что обеспечило прозрачность и оригинальность процесса обзора.
Источники данных и поисковые запросы
Мы провели всесторонний поиск англоязычных статей в MEDLINE (PubMed), EMBASE, Кокрановской библиотеке, SCOPUS и UpToDate, опубликованных до июля 2016 г. Ключевые слова для поиска были следующими: контролируемая стимуляция яичников (COS), контролируемая гиперстимуляция яичников. (COH), ART, in vitro, оплодотворение (IVF), интрацитоплазматическая инъекция сперматозоидов (ICSI), лютеинизирующий гормон (LH), фолликулостимулирующий гормон (FSH), менопаузальный гонадотропин человека (hMG), hCG, фоллитропин, извлеченные ооциты и беременность.Булевы функции И и ИЛИ использовались для объединения ключевых слов, перечисленных выше.
Ключевые слова для поиска были следующими: контролируемая стимуляция яичников (COS), контролируемая гиперстимуляция яичников. (COH), ART, in vitro, оплодотворение (IVF), интрацитоплазматическая инъекция сперматозоидов (ICSI), лютеинизирующий гормон (LH), фолликулостимулирующий гормон (FSH), менопаузальный гонадотропин человека (hMG), hCG, фоллитропин, извлеченные ооциты и беременность.Булевы функции И и ИЛИ использовались для объединения ключевых слов, перечисленных выше.
Критерии отбора и включения исследований
Виды занятий
Критерии включения, установленные перед поиском литературы, составляли
.• Проспективные, продольные и контролируемые клинические испытания;
• Набор женщин без ограничения возраста;
• Лечение ЛГ, ХГЧ или ЧМГ во время фазы развития фолликулов.
Ретроспективные исследования не включены.Аналогичным образом, испытания с участием женщин с синдромом поликистозных яичников (СПКЯ) были исключены из-за специфических эндокринных особенностей этих пациентов. Выбранная методология АРТ не была критерием включения или исключения. Однако каждый результат дополнительно оценивался с учетом исследований на основе используемого протокола АРТ. Наконец, рандомизация не считалась строгим критерием включения, поэтому были рассмотрены рандомизированные, полурандомизированные и нерандомизированные клинические испытания. Таким образом, все доступные контролируемые исследования рассматривались как увеличивающие размер выборки, несмотря на широкий спектр доступных клинических протоколов.
Выбранная методология АРТ не была критерием включения или исключения. Однако каждый результат дополнительно оценивался с учетом исследований на основе используемого протокола АРТ. Наконец, рандомизация не считалась строгим критерием включения, поэтому были рассмотрены рандомизированные, полурандомизированные и нерандомизированные клинические испытания. Таким образом, все доступные контролируемые исследования рассматривались как увеличивающие размер выборки, несмотря на широкий спектр доступных клинических протоколов.
Тип участников
Было рассмотреноженщин, проходящих COS для АРТ. Критерии включения не применялись к мужчине-партнеру бесплодной пары.
Тип вмешательства
Были рассмотрены все протоколы стимуляции АРТ и включены исследования, в которых проводилось сравнение ЛГ, ХГЧ или ЧМГ в фолликулярной фазе с ФСГ.
Процесс и качество сбора данных
Два автора (Санти Даниэле и Казарини Ливио) извлекли выдержки из всех исследований, найденных в ходе литературного поиска до июля 2016 года. Все отрывки были оценены по критериям включения, и данные были извлечены из каждого исследования, которое считалось подходящим, в отношении дизайна исследования, года публикации, количества включенных / исключенных субъектов, количества выбывших пациентов и использования намерения лечить или по протоколу анализа.
Все отрывки были оценены по критериям включения, и данные были извлечены из каждого исследования, которое считалось подходящим, в отношении дизайна исследования, года публикации, количества включенных / исключенных субъектов, количества выбывших пациентов и использования намерения лечить или по протоколу анализа.
Качество исследований оценивалось с использованием параметров, предложенных Jadad et al. (14) и таблица 2 суммирует особенности выбранных исследований.
Таблица 2. Характеристики включенных исследований .
Хотя в исследованиях, рассмотренных в метаанализе, использовались разные конечные точки, мы выполнили общий метаанализ с учетом всех исследований, оценивающих, по крайней мере, частоту наступления беременности или количество извлеченных ооцитов.
Исследователи (DS и LC), используя Кокрановский алгоритм оценки риска систематической ошибки, независимо оценили риск систематической ошибки для всех испытаний. Следующие критерии качества и методологические детали были оценены для каждого испытания, включенного в метаанализ: (i) метод рандомизации, даже если рандомизация не была критерием включения; (ii) сокрытие распределения; (iii) наличие или отсутствие скрытия от назначения лечения; (iv) продолжительность и тип лечения и фазы последующего наблюдения; (v) количество участников, набранных, проанализированных или потерянных для последующего наблюдения; (vi) сроки судебного разбирательства; (vii) было ли сделано намерение лечить анализ; (viii) производился ли расчет мощности; (ix) источник финансирования; и (x) критерии включения участников и оценки результатов.
Сводные показатели
Первичным результатом было количество извлеченных ооцитов, оцениваемое как средняя разница между двумя сравниваемыми типами лечения. Выбор первичной конечной точки основан на том соображении, что количество извлеченных ооцитов является уникальной конечной точкой, доступной почти во всех испытаниях в условиях АРТ. Более того, наш метаанализ, направленный на сравнение эффективности in vivo комбинаций гонадотропинов и количества извлеченных ооцитов, лучше всего описывает патофизиологически первый шаг, на который влияет введение гонадотропинов, т.е.е., развитие фолликулов и ооцитов. Число ооцитов остается первым измеряемым и воспроизводимым параметром, описывающим действие гонадотропина in vivo .
В клинической практике основным результатом АРТ остается живорождение. Однако этот параметр не рассматривался в качестве основной конечной точки в нашем метаанализе, поскольку на него влияет большое количество не поддающихся количественной оценке систематических ошибок и переменных.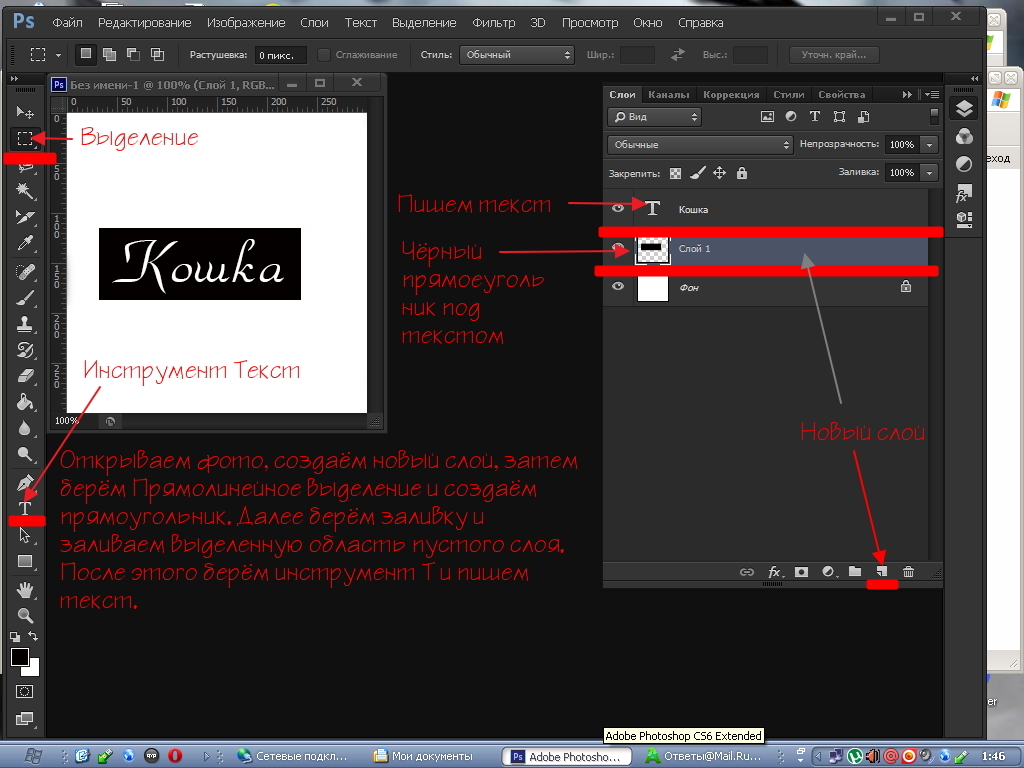 Действительно, в подавляющем большинстве клинических исследований, посвященных результатам АРТ, этот параметр не сообщается.Фактически, этап, следующий за забором ооцитов, то есть развитие эмбриона, сильно зависит от другого важного смешивающего фактора, то есть качества спермы, которое обычно (и необъяснимо) не принимается во внимание. Кроме того, частота имплантации следует за развитием эмбриона и, в свою очередь, зависит от других факторов, таких как толщина и активность эндометрия, которые обычно не контролируются. До наступления беременности и рождения живого ребенка каждый этап зависит от ряда факторов, не зависящих непосредственно от гонадотропинов.Соответственно, связь между коэффициентом живорождения и полученными ооцитами предлагается в литературе (15), но не является общепринятой (16, 17). По этим причинам невозможно определить уникальную конечную точку для оценки результатов COS. Таким образом, мы рассматривали каждый доступный результат COS после количества извлеченных ооцитов в качестве вторичных конечных точек, то есть количество ооцитов MII, эмбрионов, частоту имплантации, частоту наступления беременности и частоту живорождений.
Действительно, в подавляющем большинстве клинических исследований, посвященных результатам АРТ, этот параметр не сообщается.Фактически, этап, следующий за забором ооцитов, то есть развитие эмбриона, сильно зависит от другого важного смешивающего фактора, то есть качества спермы, которое обычно (и необъяснимо) не принимается во внимание. Кроме того, частота имплантации следует за развитием эмбриона и, в свою очередь, зависит от других факторов, таких как толщина и активность эндометрия, которые обычно не контролируются. До наступления беременности и рождения живого ребенка каждый этап зависит от ряда факторов, не зависящих непосредственно от гонадотропинов.Соответственно, связь между коэффициентом живорождения и полученными ооцитами предлагается в литературе (15), но не является общепринятой (16, 17). По этим причинам невозможно определить уникальную конечную точку для оценки результатов COS. Таким образом, мы рассматривали каждый доступный результат COS после количества извлеченных ооцитов в качестве вторичных конечных точек, то есть количество ооцитов MII, эмбрионов, частоту имплантации, частоту наступления беременности и частоту живорождений. Кроме того, использованная доза ФСГ и соотношение доза ФСГ / количество извлеченных ооцитов были оценены, чтобы описать количество гонадотропина, необходимое для получения каждого ооцита.”
Кроме того, использованная доза ФСГ и соотношение доза ФСГ / количество извлеченных ооцитов были оценены, чтобы описать количество гонадотропина, необходимое для получения каждого ооцита.”
Синтез и анализ данных
Метаанализ был проведен с использованием программного обеспечения Review Manager (RevMan) (версия 5.3.1, Копенгаген: Северный Кокрановский центр, Кокрановское сотрудничество, 2014 г.). Данные были объединены с использованием модели фиксированного эффекта и взвешенных средних разностей, и 95% доверительные интервалы были оценены для каждой конечной точки. Модель случайного эффекта использовалась, когда в результате исследований была высокая неоднородность, согласно статистике I 2 .Мета-регрессионный анализ проводился для оценки взаимосвязи между непрерывными переменными.
Значения p <0,05 считались статистически значимыми.
Риск смещения в исследованиях
Два автора (Санти Даниэле и Казарини Ливио) независимо оценили риск систематической ошибки. Хотя рандомизация не является строгим критерием включения, она была оценена как источник систематических ошибок в соответствии с предложениями, предоставленными Кокрановским сотрудничеством.
Хотя рандомизация не является строгим критерием включения, она была оценена как источник систематических ошибок в соответствии с предложениями, предоставленными Кокрановским сотрудничеством.
Результаты
Из 2117 первоначально идентифицированных публикаций 1602 остались после удаления дубликатов.Согласно исследованию стратегии, мы выявили 196 потенциально релевантных исследований, основанных на информации, приведенной в аннотации. Все испытания были тщательно проверены на соответствие критериям метаанализа и методологическое качество. Семьдесят исследований были включены в окончательный анализ (Таблица 2; Рисунок 1).
Рисунок 1. Схема исследования .
Соображения по поводу дизайна исследования
Средний возраст всех пациентов составил 33,21 ± 3,43 года. Учитывая широкую неоднородность клинических испытаний, включенных в анализ, в отношении критериев включения, выбранной начальной дозы ФСГ и подходов к АРТ, было выполнено несколько анализов подгрупп (таблица 3). При анализе подгрупп исследования были разделены в соответствии с используемым аналогом, агонистом или антагонистом GnRH, соответственно. Из анализа подгрупп были исключены три исследования, поскольку чМГ вводили вместе с ФСГ (18–20). Недостаточное количество исследований было доступно по сравнению только ФСГ с ФСГ + ХГЧ и между ФСГ + ЛГ и ФСГ + ХГЧ, что ограничивало возможность исследований в подгруппах. Наконец, учитывая всю группу исследований, включенных в метаанализ, подходы к АРТ, выбранные после COS, были разными, от внутриматочной инсеминации (ВМИ) до интрацитоплазматической инъекции сперматозоидов (ИКСИ).Однако только четыре исследования оценивали ВМИ (21–24), таким образом, подавляющее большинство исследований, включенных в анализ, рассматривали ЭКО / ИКСИ. Более того, из этих четырех исследований в трех сравнивали чМГ только с ФСГ (21–23) и в одном ЛГ + ФСГ только с ФСГ + ХГЧ (24). Таким образом, был проведен анализ подгрупп, за исключением исследований, выполняющих ВМИ.
При анализе подгрупп исследования были разделены в соответствии с используемым аналогом, агонистом или антагонистом GnRH, соответственно. Из анализа подгрупп были исключены три исследования, поскольку чМГ вводили вместе с ФСГ (18–20). Недостаточное количество исследований было доступно по сравнению только ФСГ с ФСГ + ХГЧ и между ФСГ + ЛГ и ФСГ + ХГЧ, что ограничивало возможность исследований в подгруппах. Наконец, учитывая всю группу исследований, включенных в метаанализ, подходы к АРТ, выбранные после COS, были разными, от внутриматочной инсеминации (ВМИ) до интрацитоплазматической инъекции сперматозоидов (ИКСИ).Однако только четыре исследования оценивали ВМИ (21–24), таким образом, подавляющее большинство исследований, включенных в анализ, рассматривали ЭКО / ИКСИ. Более того, из этих четырех исследований в трех сравнивали чМГ только с ФСГ (21–23) и в одном ЛГ + ФСГ только с ФСГ + ХГЧ (24). Таким образом, был проведен анализ подгрупп, за исключением исследований, выполняющих ВМИ.
Таблица 3.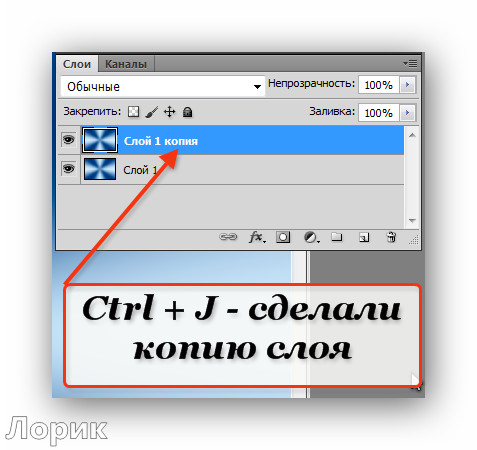 Количество исследований, оцененных в каждом сравнении и в анализе каждой подгруппы .
Количество исследований, оцененных в каждом сравнении и в анализе каждой подгруппы .
Число извлеченных ооцитов
Двадцать девять исследований оценивали сравнение только ФСГ иФСГ + ЛГ, всего 5840 пациентов. В исследованиях с использованием одного ФСГ было получено значительно большее количество ооцитов по сравнению с лечением ФСГ + ЛГ ( p = 0,010) (рис. 2А; таблица 4). Однако в зависимости от протокола COS были получены разные результаты. В частности, было получено более высокое количество ооцитов, когда ФСГ вводили отдельно в протоколе агониста ГнРГ ( p = 0,010), в то время как никаких различий не наблюдалось в протоколе антагониста ГнРГ ( p = 0,840) (Таблица 4).
Рисунок 2.График Форреста, оценивающий количество извлеченных ооцитов, сравнивающий один фолликулостимулирующий гормон с лютеинизирующим гормоном (A), хорионическим гонадотропином человека (B) и менопаузальным гонадотропином человека (C) .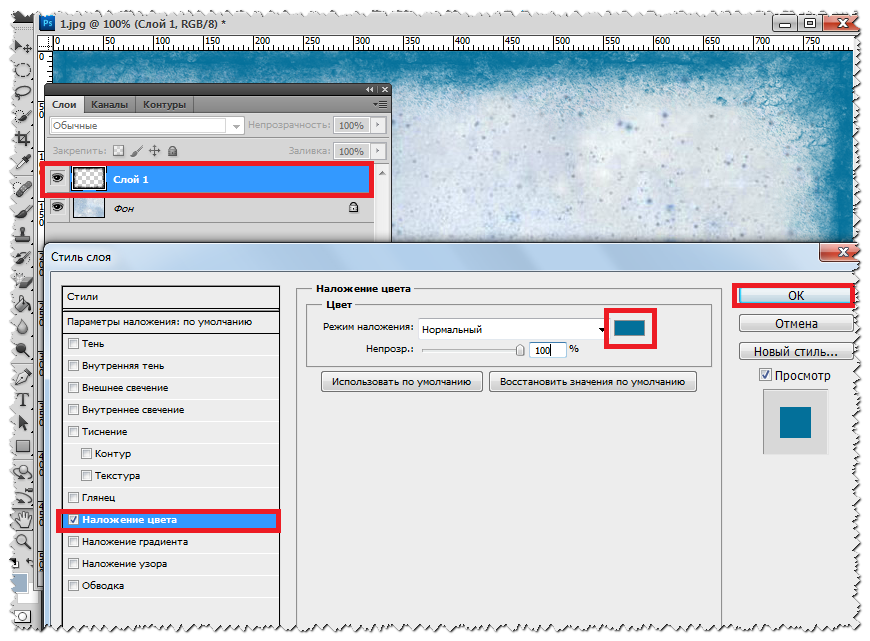
Таблица 4. Основные результаты метаанализа подгруппы .
Было проведено сравнение семи исследований, в которых использовался только ФСГ, и ФСГ + ХГЧ, всего у 948 пациентов. Общий анализ не обнаружил значительных различий в количестве полученных ооцитов между группами ( p = 0.850) (Рисунок 2B; Таблица 4).
В двадцати исследованиях сравнивали чМГ и ФСГ для определения COS, всего у 5 512 пациентов. Количество извлеченных ооцитов было значительно выше в группе ФСГ, чем в группе чМГ ( p <0,001) (Рисунок 2C; Таблица 4). В четырех из этих исследований использовался протокол антагонистов ГнРГ, подтверждающий значительное увеличение извлеченных ооцитов ( p <0,001), но никаких различий не было обнаружено в 16 исследованиях с использованием протокола агонистов GnRH ( p = 0,110) (Таблица 4).
Наконец, 5 исследований оценивали количество ооцитов, сравнивая ФСГ плюс ЛГ с ФСГ плюс ХГЧ, всего у 538 женщин. Анализ не обнаружил значимых различий между группами ( p = 0,530) (Таблица 4).
Анализ не обнаружил значимых различий между группами ( p = 0,530) (Таблица 4).
Соотношение доза ФСГ / извлеченные ооциты
Соотношение ФСГ / извлеченные ооциты было значительно ниже, когда ЛГ был добавлен к ФСГ ( p <0,001) (таблица 4), как было оценено в 26 исследованиях, в которых приняли участие 5 404 женщины. Однако разные результаты были получены в зависимости от используемого протокола COS. В частности, не наблюдалось значительных различий в протоколе агонистов ГнРГ ( p = 0.080) (таблица 4). Напротив, более низкое соотношение было получено при добавлении ЛГ к ФСГ в протоколе антагонистов ГнРГ ( p <0,001) (Таблица 4).
С другой стороны, в 6 исследованиях сравнивали использование только ФСГ с ФСГ плюс ХГЧ, всего у 893 пациентов. Общий анализ не обнаружил значительных различий в соотношении между дозой ФСГ и ооцитами, извлеченными между группами ( p = 0,550) (Таблица 4).
В пятнадцати исследованиях сравнивали чМГ и ФСГ для определения COS, в общей сложности с участием 4436 пациентов.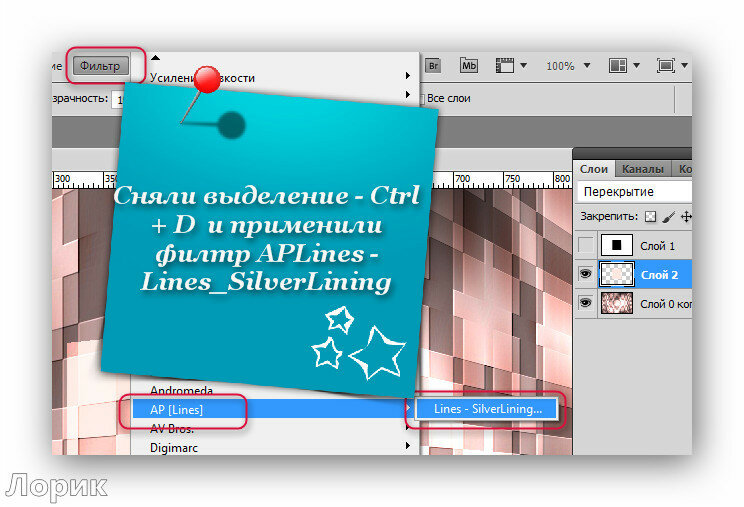 Соотношение между дозой ФСГ и количеством извлеченных ооцитов было значительно ниже в группе ФСГ по сравнению с группой чМГ ( p <0,001) (Таблица 4). Это значимое различие было потеряно в 12 исследованиях с использованием протокола агонистов GnRH ( p = 0,090), тогда как оставалось в трех исследованиях с использованием протокола антагонистов GnRH ( p <0,001) (Таблица 4).
Соотношение между дозой ФСГ и количеством извлеченных ооцитов было значительно ниже в группе ФСГ по сравнению с группой чМГ ( p <0,001) (Таблица 4). Это значимое различие было потеряно в 12 исследованиях с использованием протокола агонистов GnRH ( p = 0,090), тогда как оставалось в трех исследованиях с использованием протокола антагонистов GnRH ( p <0,001) (Таблица 4).
Наконец, 4 исследования оценивали соотношение, сравнивающее ФСГ плюс ЛГ и ФСГ плюс ХГЧ, всего у 382 женщин. Не было обнаружено различий в соотношении ФСГ / извлеченные ооциты между группами ( p = 0.480) (таблица 4).
MII Ооциты
Двадцать исследований сообщали о количестве ооцитов MII, сравнивая только ФСГ и ФСГ + ЛГ. Эти две группы не различались, учитывая среднее количество ооцитов MII ( p = 0,050), даже когда протоколы агонистов или антагонистов GnRH рассматривались отдельно ( p = 0,050 и p = 0,540, соответственно) (Таблица 4).
В пяти исследованиях сравнивали только ФСГ с ФСГ + ХГЧ, не обнаружив различий в среднем количестве ооцитов MII ( p = 0.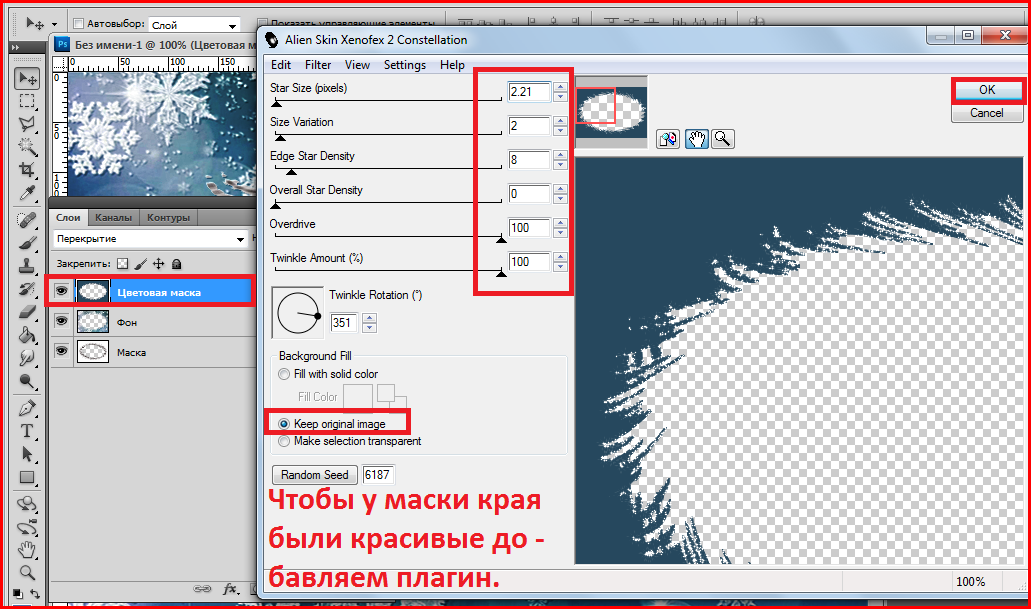 730) (таблица 4).
730) (таблица 4).
В одиннадцати исследованиях сравнивали ФСГ и чМГ, не обнаружив различий в средней разнице для ооцитов MII ( p = 0,100) (Таблица 4). Хотя этот результат сохранился и с учетом протоколов агонистов ГнРГ ( p = 0,840), количество ооцитов MII было значительно выше, когда использовался ФСГ, а не чМГ ( p <0,001) (Таблица 4).
Четыре исследования сравнивали напрямую ФСГ + ЛГ с ФСГ + чМГ, не обнаружив разницы в количестве ооцитов MII ( p = 0.070) (таблица 4).
Эмбрионы
Двадцать шесть исследований сообщили о количестве эмбрионов при сравнении только ФСГ с ФСГ + ЛГ, без существенных различий ( p = 0,540) (Таблица 4). Точно так же не наблюдали различий в группе агонистов GnRH ( p = 0,430) и антагонистов ( p = 0,640).
Семь исследований продемонстрировали аналогичное количество эмбрионов при сравнении одного ФСГ с ФСГ + ХГЧ ( p = 0,770) (Таблица 4).
Шестнадцать исследований описали количество эмбрионов при сравнении ФСГ и чМГ.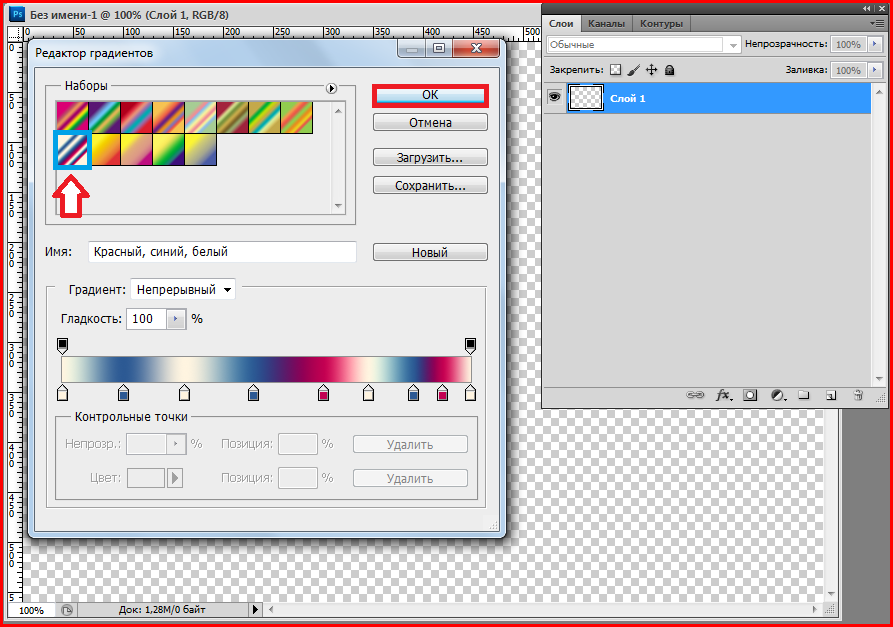 В этой подгруппе чМГ показал более высокое количество эмбрионов ( p = 0,001), которое сохранялось при использовании агониста GnRH ( p <0,001), но не в группе антагонистов GnRH ( p = 0,860) (Таблица 4) .
В этой подгруппе чМГ показал более высокое количество эмбрионов ( p = 0,001), которое сохранялось при использовании агониста GnRH ( p <0,001), но не в группе антагонистов GnRH ( p = 0,860) (Таблица 4) .
Прямое сравнение между ФСГ + ЛГ и ФСГ + чМГ продемонстрировало более высокое количество эмбрионов, когда ФСГ использовался в сочетании с ЛГ ( p <0,001) (Таблица 4).
Скорость имплантации
Частота имплантации рассчитывалась как соотношение между количеством гестационных мешков и количеством перенесенных эмбрионов.Об этом сообщалось в 15 исследованиях, сравнивающих только ФСГ с ФСГ + ЛГ, демонстрируя аналогичную частоту ( p = 0,050), сохраняемую как в протоколах с агонистом GnRH ( p = 0,050), так и с протоколами антагонистов ( p = 0,830) ( Таблица 4).
Пять исследований продемонстрировали равную частоту имплантации при сравнении одного ФСГ с ФСГ + ХГЧ ( p = 0,590) (Таблица 4).
Десять исследований показали более высокую частоту имплантации при использовании чМГ вместо ФСГ ( p = 0.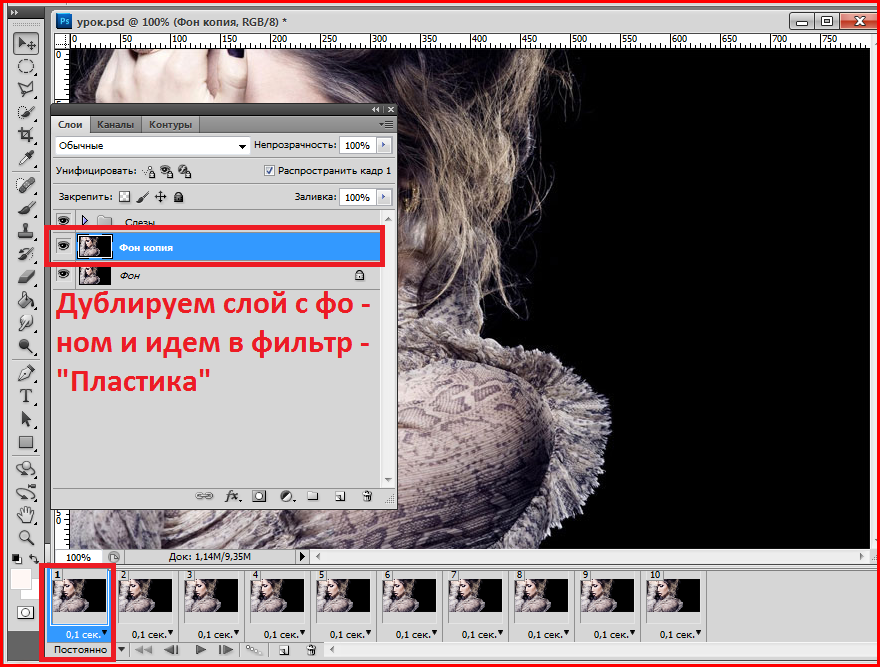 030) (таблица 4). Этот результат остался в группе антагонистов GnRH ( p <0,001), но не в группе агонистов GnRH ( p = 0,060) (Таблица 4).
030) (таблица 4). Этот результат остался в группе антагонистов GnRH ( p <0,001), но не в группе агонистов GnRH ( p = 0,060) (Таблица 4).
Не было обнаружено разницы в скорости имплантации при прямом сравнении ФСГ + ЛГ с ФСГ + чМГ ( p = 0,980) (Таблица 4).
Показатель беременностей
Частота наступления беременности была значительно выше, когда ЛГ был добавлен к ФСГ ( p = 0,004), как оценивалось в 29 исследованиях, в которых участвовало в общей сложности 5 565 женщин (Рисунок 3A; Таблица 4).
Рисунок 3. График Форреста, оценивающий частоту наступления беременности при сравнении одного фолликулостимулирующего гормона с лютеинизирующим гормоном (A), хорионическим гонадотропином человека (B) и менопаузальным гонадотропином человека (C) .
Аналогичным образом, более высокая частота наступления беременности в группе ФСГ плюс ЛГ поддерживалась только при использовании агониста ГнРГ ( p = 0,002), а не с антагонистом ГнРГ ( p = 0,480) (Таблица 4).
В восьми исследованиях сравнивали использование только ФСГ иФСГ + ХГЧ, всего 968 пациентов. Общий анализ не обнаружил значительных различий в частоте наступления беременности между группами ( p = 0,750) (Рисунок 3B; Таблица 4).
В двадцати пяти исследованиях сравнивали чМГ и ФСГ во время COS, всего у 6894 пациента. Частота наступления беременности не различалась между группами ( p = 0,100) (Рисунок 3C; Таблица 4). Однако частота наступления беременности была значительно выше, когда чМГ использовался в протоколе с агонистами ГнРГ ( p = 0,030), в то время как он не изменился в режиме антагонистов GnRH ( p = 0.370) (таблица 4). При сравнении чМГ и только ФСГ, учитывая только циклы ЭКО / ИКСИ, в анализе осталось 22 исследования, в общей сложности 6 354 пациента. Частота наступления беременности не различалась между группами ( p = 0,070) (рисунок S1 в дополнительных материалах). Учитывая только протоколы агонистов ГнРГ, в анализе осталось 18 исследований, подтверждающих улучшение частоты наступления беременности в группе чМГ по сравнению с одним ФСГ ( p = 0,003) (рис.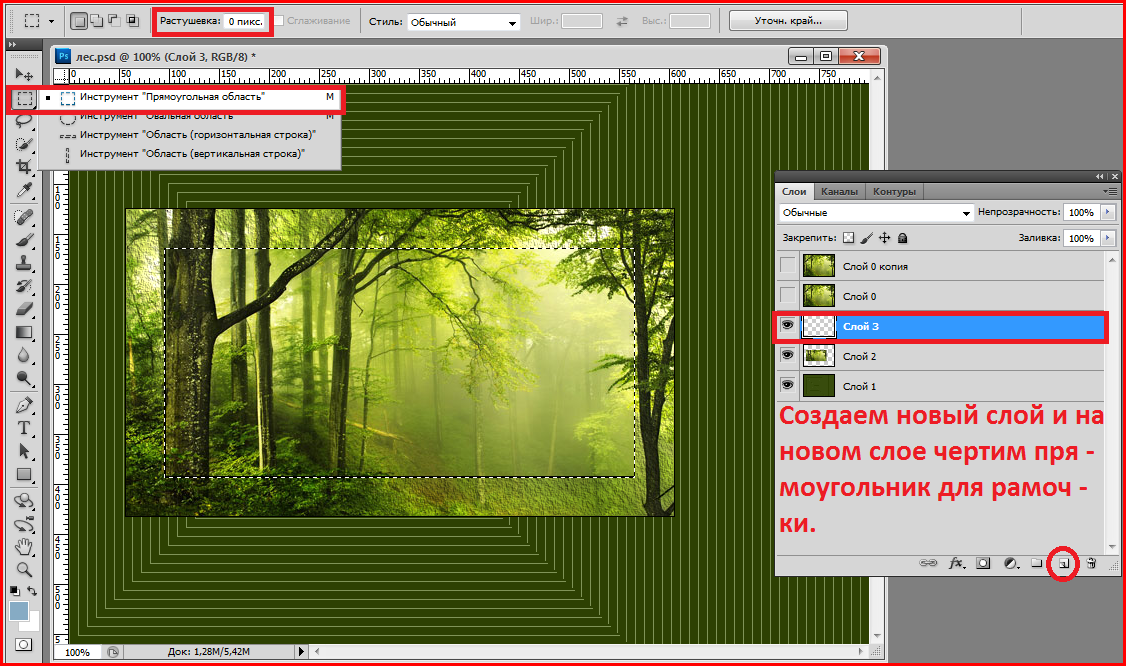 S2 в дополнительных материалах).
S2 в дополнительных материалах).
Наконец, пять исследований оценивали частоту наступления беременности, сравнивая ФСГ + ЛГ иФСГ + ХГЧ, всего 989 женщин. Более высокая частота наступления беременности наблюдалась при добавлении ЛГ к ФСГ, а не ХГЧ ( p <0,001) (Таблица 4).
Коэффициент живорождений
В пяти исследованиях сообщалось о коэффициенте живорождения при сравнении одного ФСГ с ФСГ + ЛГ без значимых различий ( p = 0,150) (Таблица 4). Аналогичный результат был получен при сравнении одного ФСГ с ФСГ + ХГЧ (8 исследований, p = 0,750) и с чМГ (7 исследований, p = 0.170) (таблица 4).
Мета-регрессионный анализ
С учетом анализа каждой подгруппы количество извлеченных ооцитов было напрямую связано с кумулятивной дозой ФСГ при использовании одного ФСГ ( R = 0,342, p = 0,002) вместо комбинации ФСГ + ЛГ ( R = 0,146, р = 0,060). Напротив, кумулятивная доза ФСГ не была связана с количеством ооцитов при сравнении ФСГ с чМГ ( R = 0,022, p = 0. 543).
543).
Риск смещения
Риск систематической ошибки был оценен и резюмирован на Рисунке 4.
Рис. 4. График риска систематической ошибки: оценка авторов по каждому пункту риска систематической ошибки представлена в виде процентов по всем включенным исследованиям .
Общая модель
Основные концепции, обнаруженные в результате нашего анализа данных, были графически обобщены в виде графика (рис. 5), представляющего средние значения и 95% доверительные интервалы для каждого этапа оплодотворения и режима приема гонадотропинов, как подробно описано в подразделах выше.В этой общей модели COS служил примером эффективности гонадотропинов in vivo , демонстрируя действие ЛГ и ХГЧ на яичники (фиг. 5). Полиномиальные функции второго порядка использовались в качестве подгоночной модели стандартных средних различий (по оси Y), рассчитанных для каждой конечной точки метаанализа, с учетом ФСГ + ЛГ по сравнению с одним ФСГ, ФСГ + ХГЧ по сравнению с одним ФСГ и чМГ. по сравнению с ФСГ (рис. 5). Число извлеченных ооцитов выше, когда ФСГ используется отдельно во всех сравнениях, но добавление активности ЛГ или ЛГ (например, в случае чМГ) прогрессивно улучшает результаты АРТ, предполагая положительное влияние ЛГ на качество ооцитов.В частности, ооциты MII, эмбрионы, частота имплантации и частота наступления беременности улучшаются постепенно и линейно при использовании ЛГ (красная линия), эффект ослабляется при использовании чМГ (синяя линия) (рис. 5). Напротив, добавление ХГЧ не улучшает исход АРТ (черная линия) (рис. 5).
по сравнению с ФСГ (рис. 5). Число извлеченных ооцитов выше, когда ФСГ используется отдельно во всех сравнениях, но добавление активности ЛГ или ЛГ (например, в случае чМГ) прогрессивно улучшает результаты АРТ, предполагая положительное влияние ЛГ на качество ооцитов.В частности, ооциты MII, эмбрионы, частота имплантации и частота наступления беременности улучшаются постепенно и линейно при использовании ЛГ (красная линия), эффект ослабляется при использовании чМГ (синяя линия) (рис. 5). Напротив, добавление ХГЧ не улучшает исход АРТ (черная линия) (рис. 5).
Рисунок 5. Общая модель результатов метаанализа . Каждая диаграмма разброса представляет собой средние различия с соответствующим доверительным интервалом (95%) для каждого оцениваемого результата вспомогательных репродуктивных технологий.Три линии представляют полиномиальную линию тренда. Красная линия показывает результаты с добавлением лютеинизирующего гормона, синяя линия - с человеческим менопаузальным гонадотропином и черная линия - с хорионическим гонадотропином человека.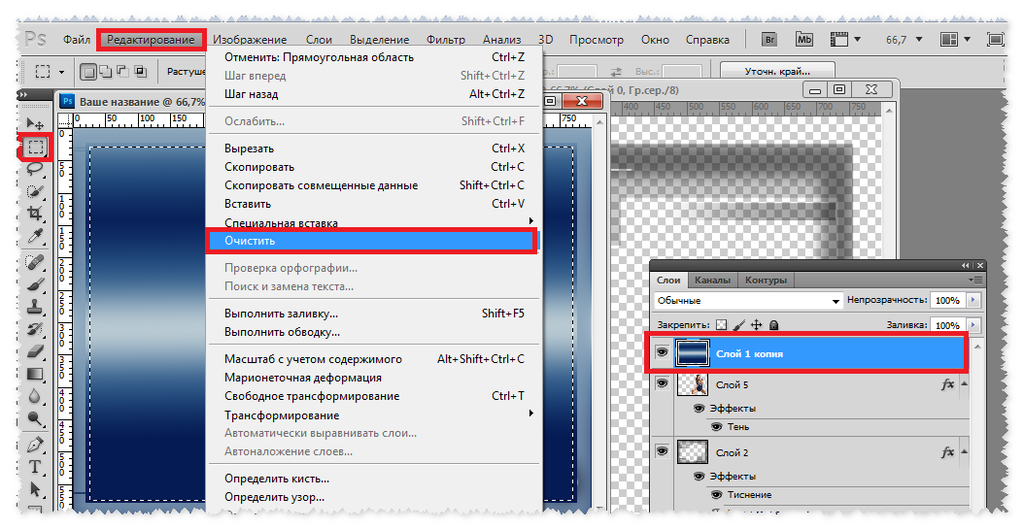
Обсуждение
Это первый метаанализ, всесторонне сравнивающий эффективность наиболее часто используемых комбинаций гонадотропинов при АРТ. Мы обнаружили, что введение только ФСГ во время COS восстанавливает большее количество ооцитов, чем добавление ЛГ или использование чМГ.Однако комбинированное использование ФСГ + ЛГ снижает дозу ФСГ, необходимую для извлечения ооцитов, в то время как чМГ приводит к более высокой необходимой дозе ФСГ. Интересно, что ФСГ + ЛГ увеличивает частоту наступления беременности примерно в 1,20 раза, несмотря на меньшее количество извлеченных ооцитов по сравнению с одним ФСГ, тогда как чМГ этого не делает. Напротив, лечение ФСГ + ХГЧ не влияет ни на окончательное количество ооцитов, ни на дозу ФСГ, требуемую для каждого ооцита, ни на частоту наступления беременности. Хотя коэффициент живорождения обычно считается лучшим конечным показателем для оценки результатов АРТ, чем коэффициент беременностей, он не сообщается во многих включенных исследованиях, и наш метаанализ не показывает значительных различий в уровне живорождения.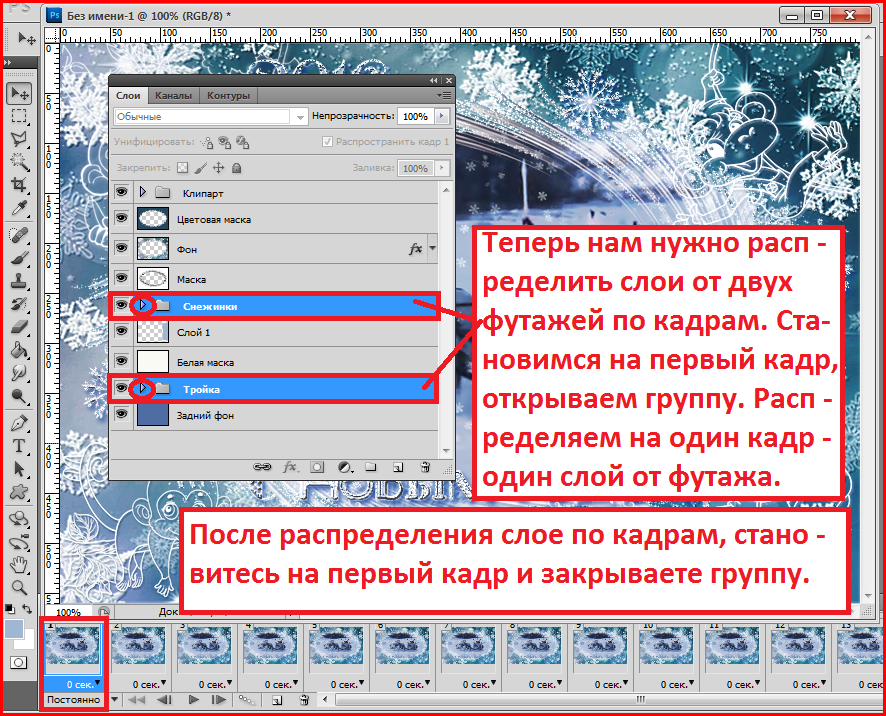 Все эти различия незначительны, но, хотя, очевидно, не имеют клинического значения, они полезны для лучшего понимания in vivo общих эффектов различных схем лечения гонадотропинами.
Все эти различия незначительны, но, хотя, очевидно, не имеют клинического значения, они полезны для лучшего понимания in vivo общих эффектов различных схем лечения гонадотропинами.
Эти результаты предполагают, что препараты гонадотропина по-разному влияют на исход COS, обеспечивая некоторые доказательства персонализации и улучшения АРТ и приводя к другим результатам по сравнению с результатами предыдущих метаанализов. Это различие может быть связано с широким спектром оцениваемых исследований, в которых основное внимание уделяется различным конечным точкам и характеристикам пациентов.Лечение ФСГ + ЛГ связано с относительно меньшим количеством извлекаемых ооцитов, но с более высокой частотой наступления беременности. Добавление LH или LH-активности может увеличить избирательное давление, оказываемое на отбор фолликулов двумя гонадотропинами вместе, компенсируемое улучшенным качеством ооцитов. Действительно, различия между одним ФСГ и активностью ФСГ + ЛГ или ЛГ теряются, по крайней мере, с точки зрения числа ооцитов MII.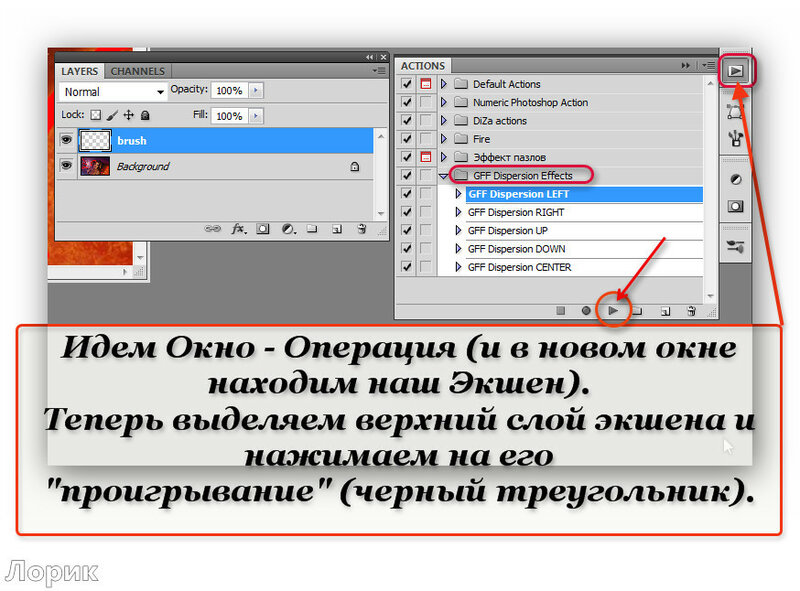 Более того, использование чМГ приводит к большему количеству эмбрионов и скорости имплантации по сравнению с одним ФСГ.Эти результаты подтвердили, что более высокая частота наступления беременности, обнаруженная при использовании ФСГ + ЛГ или чМГ вместе с протоколом агонистов ГнРГ вместо одного ФСГ, обусловлена положительным влиянием лучшего качества ооцитов на оплодотворение и имплантацию эмбриона. Напротив, лечение ФСГ + ХГЧ не меняет исходы АРТ по сравнению с одним ФСГ, что позволяет предположить, что ЛГ и ХГЧ вызывают разные действия in vivo в присутствии ФСГ, что отражает наблюдений in vitro (3). Общая модель (рис. 5) показывает прогрессивно лучший результат, когда ФСГ используется вместе с ЛГ или активностью ЛГ (например, чМГ).Таким образом, действие ЛГ и ХГЧ in vivo различается у женщин, перенесших COS, при этом ЛГ улучшает созревание и качество ооцитов и, следовательно, частоту наступления беременности больше, чем ХГЧ, что отражает предыдущие данные in vitro .
Более того, использование чМГ приводит к большему количеству эмбрионов и скорости имплантации по сравнению с одним ФСГ.Эти результаты подтвердили, что более высокая частота наступления беременности, обнаруженная при использовании ФСГ + ЛГ или чМГ вместе с протоколом агонистов ГнРГ вместо одного ФСГ, обусловлена положительным влиянием лучшего качества ооцитов на оплодотворение и имплантацию эмбриона. Напротив, лечение ФСГ + ХГЧ не меняет исходы АРТ по сравнению с одним ФСГ, что позволяет предположить, что ЛГ и ХГЧ вызывают разные действия in vivo в присутствии ФСГ, что отражает наблюдений in vitro (3). Общая модель (рис. 5) показывает прогрессивно лучший результат, когда ФСГ используется вместе с ЛГ или активностью ЛГ (например, чМГ).Таким образом, действие ЛГ и ХГЧ in vivo различается у женщин, перенесших COS, при этом ЛГ улучшает созревание и качество ооцитов и, следовательно, частоту наступления беременности больше, чем ХГЧ, что отражает предыдущие данные in vitro .
Лютеинизирующий гормон и ХГЧ характеризуются специфическими молекулярными и биохимическими особенностями; они взаимодействуют с разными сайтами связывания одного и того же рецептора (25–27), что приводит к более низкой скорости диссоциации ХГЧ, чем связывание ЛГ (28). Характеристики гонадотропин-специфического лиганда-рецептора подразумевают различную экспрессию генов и внутриклеточную передачу сигналов in vitro , при этом ЛГ запускает более высокие уровни активации путей ERK1 / 2 и AKT, чем ХГЧ, что, в свою очередь, опосредует более сильное увеличение цАМФ в первичных человеческих клетках. granulosa клетки (2).Последующие эффекты передачи сигналов гонадотропинов состоят в пролиферативных и антиапоптотических сигналах, связанных с ЛГ, в сравнении с высоким стероидогенным потенциалом и проапоптотической активностью ХГЧ in vitro как в первичных клетках гранулезы человека, так и козы (3, 29). В частности, смерть клеток была описана в результате внутриклеточного взаимодействия между стероидогенными и проапоптотическими путями, опосредованными цАМФ / протеинкиназой А (ПКА) (30), преимущественно активируемыми ФСГ и ХГЧ, в стероидогенных клетках in vitro (31).
Интересно, что наш анализ литературы показывает, что добавление ЛГ к лечению ФСГ при АРТ обеспечивает меньшее количество ооцитов, чем другие методы лечения, вероятно, в результате более высокого отбора фолликулов (который опосредован апоптозом). В связи с этим следует сделать несколько умозрительных размышлений. Во-первых, циклы COS - это далеко не физиологический гормональный режим; они оптимизированы для созревания нескольких фолликулов, чтобы получить наибольшее количество здоровых ооцитов (32), подвергая яичники лечению заранее разработанными высокими дозами экзогенных гормонов, которые изменяют естественную эндокринную среду женщины.В результате моноовуляторный вид становится мультиовуляторным, отклоняясь от естественного циклического баланса между гонадотропинами и стероидными гормонами (33) и, следовательно, сигналами жизни / смерти, что явно отличается от физиологии яичников. С другой стороны, ФСГ и ЛГ естественным образом вырабатываются для регулирования монофолликулярного отбора, роста и созревания. Сообщение, предоставленное исследованиями in vitro , состоит в том, что высокостероидогенные гонадотропины, то есть ФСГ и ХГЧ, опосредуют апоптотические стимулы в клетках гранулезы через путь цАМФ / PKA (2, 3, 29–31).В условиях созревания нескольких фолликулов в яичниках, как при COS, стимуляция является мощным сигналом для раннего рекрутирования третичных фолликулов (34) и запускает стероидогенез, приводит к избыточной продукции эстрогена, что, в свою очередь, вызывает более выраженную выживаемость нескольких фолликулов и созревание (35), чем индуцируется лечением ЛГ.
Сообщение, предоставленное исследованиями in vitro , состоит в том, что высокостероидогенные гонадотропины, то есть ФСГ и ХГЧ, опосредуют апоптотические стимулы в клетках гранулезы через путь цАМФ / PKA (2, 3, 29–31).В условиях созревания нескольких фолликулов в яичниках, как при COS, стимуляция является мощным сигналом для раннего рекрутирования третичных фолликулов (34) и запускает стероидогенез, приводит к избыточной продукции эстрогена, что, в свою очередь, вызывает более выраженную выживаемость нескольких фолликулов и созревание (35), чем индуцируется лечением ЛГ.
Результат АРТ, полученный с чМГ, отражает гетерогенность, типичную для этого соединения. ЧМГ получают у женщин в постменопаузе или у беременных и содержат активности как ФСГ, так и ЛГ (36).Активность ЛГ обеспечивается остаточными молекулами ЛГ и добавкой ХГЧ, что приводит к высокой вариабельности продукта (37). Более того, учитывая высокий стероидогенный потенциал ХГЧ, продемонстрированный in vitro (2, 31), что больше похоже на ФСГ, а не на ЛГ (31), неудивительно, что исход АРТ не влияет на то, используется ли вместо него чМГ. ФСГ, за исключением протоколов агонистов ГнРГ, где высокое количество ооцитов могло бы иметь место как положительный эффект фазы обострения на рекрутирование фолликулов.Расхождения, представленные протоколами агонистов и антагонистов ГнРГ, не были продемонстрированы предыдущими метаанализами, вероятно, из-за строгих критериев включения, сфокусированных именно на оценке аналога, а не комбинации гонадотропинов. Самый последний метаанализ в этой области предполагает только значительное снижение частоты нежелательных явлений при использовании антагонистов ГнРГ (38).
ФСГ, за исключением протоколов агонистов ГнРГ, где высокое количество ооцитов могло бы иметь место как положительный эффект фазы обострения на рекрутирование фолликулов.Расхождения, представленные протоколами агонистов и антагонистов ГнРГ, не были продемонстрированы предыдущими метаанализами, вероятно, из-за строгих критериев включения, сфокусированных именно на оценке аналога, а не комбинации гонадотропинов. Самый последний метаанализ в этой области предполагает только значительное снижение частоты нежелательных явлений при использовании антагонистов ГнРГ (38).
Это исследование предполагает, что протокол антагонистов GnRH может быть невыгодным для качества ооцитов, хотя добавление LH, по-видимому, компенсирует, по крайней мере частично, этот негативный эффект.Один только ФСГ позволяет извлекать большее количество ооцитов, чем ФСГ + ЛГ, в протоколах с агонистами ГнРГ, но не с антагонистами. Антагонист ГнРГ связан с более низкими дозами ФСГ, необходимыми для каждого извлеченного ооцита, в присутствии ЛГ. Более того, частота наступления беременности выше при приеме чМГ, чем при лечении ФСГ агонистами ГнРГ, но не антагонистами. Это отражает различный механизм действия и, возможно, различные эффекты среди аналогов GnRH, которые были выдвинуты, хотя в значительной степени обсуждались (39). Аналоги ГнРГ по-разному используются в клинической практике.В частности, агонисты ГнРГ обычно предлагаются женщинам с ИМТ <25 кг / м 2 (40), плохо реагирующим на лечение (38, 41) и / или в качестве последнего триггера для минимизации возникновения синдрома гиперстимуляции яичников (СГЯ). (42). В целом, антагонист ГнРГ связан с сокращением продолжительности COS и общими медицинскими затратами на фазу стимуляции и рекомендуется, когда требуется мягкая стимуляция, например, для женщин с гиперреактивностью (38, 43) или пациентов с СПКЯ (44). Эти результаты подтверждают гипотетическое различие между агонистами и антагонистами, которое никогда не было продемонстрировано предыдущими метаанализами (таблица 1).
Более того, частота наступления беременности выше при приеме чМГ, чем при лечении ФСГ агонистами ГнРГ, но не антагонистами. Это отражает различный механизм действия и, возможно, различные эффекты среди аналогов GnRH, которые были выдвинуты, хотя в значительной степени обсуждались (39). Аналоги ГнРГ по-разному используются в клинической практике.В частности, агонисты ГнРГ обычно предлагаются женщинам с ИМТ <25 кг / м 2 (40), плохо реагирующим на лечение (38, 41) и / или в качестве последнего триггера для минимизации возникновения синдрома гиперстимуляции яичников (СГЯ). (42). В целом, антагонист ГнРГ связан с сокращением продолжительности COS и общими медицинскими затратами на фазу стимуляции и рекомендуется, когда требуется мягкая стимуляция, например, для женщин с гиперреактивностью (38, 43) или пациентов с СПКЯ (44). Эти результаты подтверждают гипотетическое различие между агонистами и антагонистами, которое никогда не было продемонстрировано предыдущими метаанализами (таблица 1).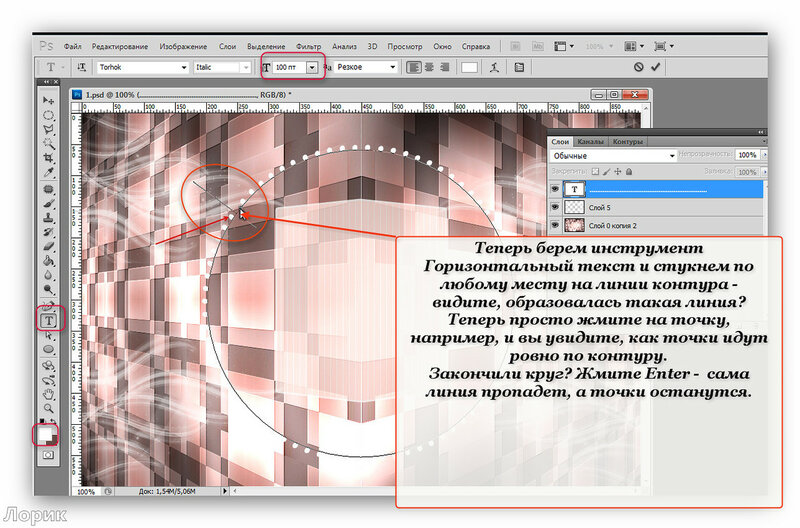
Имея это в виду, оценка экономической эффективности в настоящее время остается главной переменной, полезной при выборе клиницистом индивидуальной терапии (45). Однако оценка затрат на АРТ является особенно сложной задачей, и рассмотрение медицинских расходов, связанных как с COS, так и с беременностью / младенцем, является обязательным. В нескольких исследованиях оценивались только медицинские расходы на АРТ с учетом кумулятивных доз гонадотропинов, частоты отмены цикла и риска побочных эффектов.Исследование FASTT показало, что ВМИ была самой дешевой / эффективной терапией первой линии (46), в то время как исследование FORT-T показало лучшие результаты с точки зрения затрат при выборе последовательного традиционного переноса эмбрионов (47). Crawford et al. (48) недавно оценили общие затраты на АРТ в 14 398 циклах, предположив, что последовательный перенос эмбрионов дороже в отношении затрат на процедуру, но в целом заметно дешевле, что снижает количество живорождений и общие конечные расходы. Хотя каждое исследование кажется убедительным, эти результаты остаются неоднозначными, а международный или национальный консенсус в отношении наилучшего подхода к COS пока не достигнут.Более того, комбинация гонадотропинов обычно не рассматривается в этой оценке экономической эффективности, что ограничивает силу этих предложений. Наши результаты предполагают уменьшение дозы ФСГ, необходимой для каждого извлеченного ооцита, когда комбинация ФСГ + ЛГ использовалась для COS. Таким образом, комбинацию гонадотропина следует учитывать при оценке экономии затрат конкретной процедуры ВРТ. Общая стоимость, даже если LH, hCG или hMG используются в качестве дополнения / замены к FSH, должна учитываться в соответствии с местной системой возмещения расходов.Наконец, до сих пор ни одно исследование не оценивало «вес» компаний, производящих гонадотропины, на решение врача.
Хотя каждое исследование кажется убедительным, эти результаты остаются неоднозначными, а международный или национальный консенсус в отношении наилучшего подхода к COS пока не достигнут.Более того, комбинация гонадотропинов обычно не рассматривается в этой оценке экономической эффективности, что ограничивает силу этих предложений. Наши результаты предполагают уменьшение дозы ФСГ, необходимой для каждого извлеченного ооцита, когда комбинация ФСГ + ЛГ использовалась для COS. Таким образом, комбинацию гонадотропина следует учитывать при оценке экономии затрат конкретной процедуры ВРТ. Общая стоимость, даже если LH, hCG или hMG используются в качестве дополнения / замены к FSH, должна учитываться в соответствии с местной системой возмещения расходов.Наконец, до сих пор ни одно исследование не оценивало «вес» компаний, производящих гонадотропины, на решение врача.
Основным ограничением этого метаанализа является неоднородность включенных исследований, о чем свидетельствует повышенная оценка I 2 . Бесплодие у пар представляет собой сложное клиническое состояние, которое трудно определить по строгим клиническим критериям. Действительно, в каждом исследовании используются разные критерии включения и исключения, что затрудняет всестороннее сравнение этих результатов.В качестве подтверждения недавнее одинарное слепое рандомизированное клиническое исследование фазы III в параллельных группах, проведенное на 939 женщинах с плохим ответом, не обнаружило каких-либо различий в безопасности и эффективности между одним ФСГ и ФСГ + ЛГ (49). Это подкрепляет знания о высокой гетерогенности исследований в условиях АРТ, в которых также классификация женщин как плохо отвечающих на лечение может маскировать различные эффекты гонадотропинов in vivo . Относительно высокий риск систематической ошибки включенных исследований, как показано на рисунке 4, представляет собой важный предел, который следует тщательно учитывать при разработке дальнейших соответствующих исследований.Однако, несмотря на то, что фармакологический подход к АРТ оценивается, при анализе воронкообразных графиков нет явных систематических ошибок публикации (данные не показаны).
Бесплодие у пар представляет собой сложное клиническое состояние, которое трудно определить по строгим клиническим критериям. Действительно, в каждом исследовании используются разные критерии включения и исключения, что затрудняет всестороннее сравнение этих результатов.В качестве подтверждения недавнее одинарное слепое рандомизированное клиническое исследование фазы III в параллельных группах, проведенное на 939 женщинах с плохим ответом, не обнаружило каких-либо различий в безопасности и эффективности между одним ФСГ и ФСГ + ЛГ (49). Это подкрепляет знания о высокой гетерогенности исследований в условиях АРТ, в которых также классификация женщин как плохо отвечающих на лечение может маскировать различные эффекты гонадотропинов in vivo . Относительно высокий риск систематической ошибки включенных исследований, как показано на рисунке 4, представляет собой важный предел, который следует тщательно учитывать при разработке дальнейших соответствующих исследований.Однако, несмотря на то, что фармакологический подход к АРТ оценивается, при анализе воронкообразных графиков нет явных систематических ошибок публикации (данные не показаны).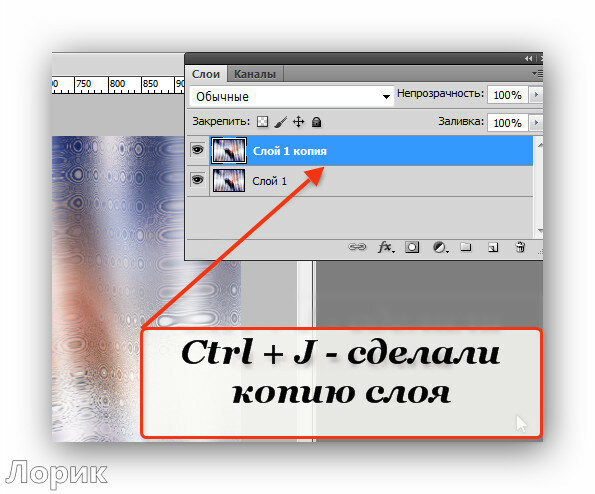 Как было подчеркнуто в предыдущих метаанализах, мы обнаружили высокие систематические ошибки отбора и распределения, подтверждая вывод о том, что более 80% клинических испытаний не применяли никаких слепых методов (50). Такой высокий процент, вероятно, связан со сложностью применения этих процедур к АРТ, в которой в настоящее время доступно более 30 терапевтических комплексных подходов.
Как было подчеркнуто в предыдущих метаанализах, мы обнаружили высокие систематические ошибки отбора и распределения, подтверждая вывод о том, что более 80% клинических испытаний не применяли никаких слепых методов (50). Такой высокий процент, вероятно, связан со сложностью применения этих процедур к АРТ, в которой в настоящее время доступно более 30 терапевтических комплексных подходов.
В заключение мы обнаружили, что различная эффективность в АРТ зависит от комбинации гонадотропинов, используемой для COS, что отражает физиологическую роль этих молекул, как ранее указывалось данными in vitro . Это приводит к важным последствиям для клинической практики, где предпочтительным исходом может быть частота наступления беременности или количество ооцитов. В частности, добавление ЛГ к ФСГ снижает потребность в ФСГ и постепенно улучшает исходы АРТ и частоту наступления беременности. В протоколах с агонистами гонадолиберина более высокая частота наступления беременности достигается при лечении ФСГ + ЛГ и чМГ. ФСГ + ХГЧ или только чМГ одинаково эффективны в отношении частоты наступления беременности по сравнению с одним ФСГ.
ФСГ + ХГЧ или только чМГ одинаково эффективны в отношении частоты наступления беременности по сравнению с одним ФСГ.
Авторские взносы
DS и LC отдельно провели поиск и оценку исследований. Все авторы участвовали в анализе, обсуждении результатов и подготовке рукописи.
Заявление о конфликте интересов
Авторы заявляют, что нет конфликта интересов, который мог бы быть воспринят как наносящий ущерб беспристрастности представленного исследования.
Финансирование
Эта работа не получала какого-либо специального гранта от какого-либо финансирующего агентства в государственном, коммерческом или некоммерческом секторе.Д.С. является стипендиатом докторской степени докторской школы клинической и экспериментальной медицины Университета Модены и Реджо-Эмилии.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу https://www.frontiersin.org/article/10.3389/fendo.2017.00114/full#supplementary-material.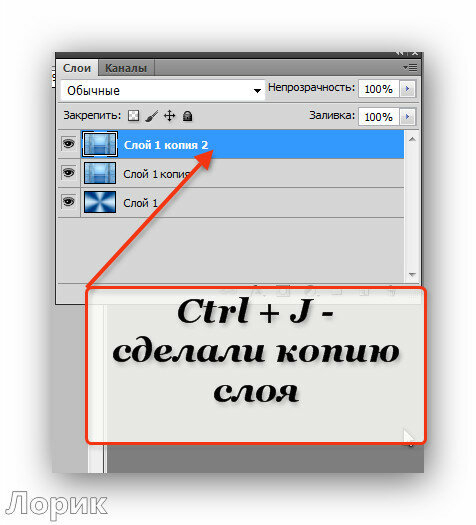
Рисунок S1. График Форреста, оценивающий частоту наступления беременности при сравнении фолликулостимулирующего гормона с менопаузальным гонадотропином человека в протоколах оплодотворения in vitro / интрацитоплазматических инъекций
Рисунок S2. График Форреста, оценивающий частоту наступления беременности при сравнении фолликулостимулирующего гормона с человеческим менопаузальным гонадотропином в протоколах in vitro, оплодотворения / интрацитоплазматической инъекции, только с использованием агониста гонадотропин-рилизинг-гормона .
Таблица S1. ПРИЗМА 2009 Контрольный список .
Лист данных 1. Результаты .
Список литературы
2. Казарини Л., Лиспи М., Лонгобарди С., Милоса Ф., Ла Марка А., Тальясакки Д. и др.Действие ЛГ и ХГЧ на один и тот же рецептор приводит к количественно и качественно разной внутриклеточной передаче сигналов. PLoS One (2012) 7 (10): e46682. DOI: 10.1371 / journal.pone.0046682
DOI: 10.1371 / journal.pone.0046682
PubMed Аннотация | CrossRef Полный текст | Google Scholar
3. Казарини Л., Риччетти Л., Де Паскали Ф., Николи А., Тальявини С., Тренти Т. и др. Фолликулостимулирующий гормон усиливает стероидогенную активность хорионического гонадотропина и антиапоптотическую активность лютеинизирующего гормона в гранулезо-лютеиновых клетках человека in vitro. Mol Cell Endocrinol (2016) 422: 103–14. DOI: 10.1016 / j.mce.2015.12.008
CrossRef Полный текст | Google Scholar
4. Баер Г., Лумэй Э. Сравнение рекомбинантного лютеинизирующего гормона человека (r-hLH) и менопаузального гонадотропина человека (hMG) в вспомогательных репродуктивных технологиях. Curr Med Res Opin (2003) 19 (2): 83–8. DOI: 10.1185 / 030079
5001498
CrossRef Полный текст | Google Scholar
5. Вонг К.М., Мастенбрук С., Реппинг С. Криоконсервация человеческих эмбрионов и ее вклад в показатели успеха экстракорпорального оплодотворения. Fertil Steril (2014) 102 (1): 19–26. DOI: 10.1016 / j.fertnstert.2014.05.027
CrossRef Полный текст | Google Scholar
6. Alviggi C, Humaidan P, Ezcurra D. Гормональные, функциональные и генетические биомаркеры в контролируемой стимуляции яичников: инструменты для сопоставления пациентов и протоколов. Reprod Biol Endocrinol (2012) 10: 9. DOI: 10.1186 / 1477-7827-10-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Shrestha D, La X, Feng HL.Сравнение различных протоколов стимуляции, используемых при экстракорпоральном оплодотворении: обзор. Ann Transl Med (2015) 3 (10): 137. DOI: 10.3978 / j.issn.2305-5839.2015.04.09
PubMed Аннотация | CrossRef Полный текст | Google Scholar
9. Эдвардс Р.Г., Степто П.С. Индукция роста фолликулов, овуляции и лютеинизации яичников человека. J Reprod Fertil Suppl (1975) 22: 121–63.
PubMed Аннотация | Google Scholar
10. Cedrin-Durnerin I, Grange-Dujardin D, Laffy A, Parneix I, Massin N, Galey J, et al.Добавка рекомбинантного человеческого ЛГ во время введения антагонистов ГнРГ в циклах ЭКО / ИКСИ: проспективное рандомизированное исследование. Hum Reprod (2004) 19 (9): 1979–84. DOI: 10.1093 / humrep / deh469
PubMed Аннотация | CrossRef Полный текст | Google Scholar
11. Пропст А.М., Хилл М.Дж., Бейтс Г.В., Палумбо М., Ван Хорн А.К., Рецлофф М.Г. Низкие дозы хорионического гонадотропина человека могут улучшить результаты цикла экстракорпорального оплодотворения у пациентов с низким уровнем лютеинизирующего гормона после введения антагониста гонадотропин-рилизинг-гормона. Fertil Steril (2011) 96 (4): 898–904. DOI: 10.1016 / j.fertnstert.2011.06.069
PubMed Аннотация | CrossRef Полный текст | Google Scholar
13. Хомпес П.Г., Брукманс Ф.Дж., Хооземанс Д.А., Шац Р., FIRM group. Эффективность высокоочищенного менопаузального гонадотропина человека по сравнению с рекомбинантным фолликулостимулирующим гормоном у пациентов первого цикла экстракорпорального оплодотворения и интрацитоплазматической инъекции сперматозоидов. Fertil Steril (2008) 89 (6): 1685–93. DOI: 10.1016 / j.fertnstert.2007.05.039
PubMed Аннотация | CrossRef Полный текст | Google Scholar
14. Джадад А. Р., Мур Р. А., Кэрролл Д., Дженкинсон С., Рейнольдс Д. Д., Гаваган Д. Д. и др. Оценка качества отчетов о рандомизированных клинических испытаниях: необходимо ли ослепление? Контрольные клинические испытания (1996) 17 (1): 1–12. DOI: 10.1016 / 0197-2456 (95) 00134-4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
15. Сункара С.К., Риттенберг В., Рейн-Феннинг Н., Бхаттачарья С., Замора Дж., Кумарасами А.Связь между количеством яйцеклеток и живорождением при лечении ЭКО: анализ 400 135 циклов лечения. Hum Reprod (2011) 26 (7): 1768–74. DOI: 10.1093 / humrep / der106
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Дракопулос П., Блокил С., Ступ Д., Камю М., де Вос М., Турне Н. и др. Обычная стимуляция яичников и перенос одного эмбриона для ЭКО / ИКСИ. Сколько ооцитов нам нужно, чтобы максимизировать совокупный коэффициент живорождения после использования всех свежих и замороженных эмбрионов? Hum Reprod (2016) 31 (2): 370–6.DOI: 10.1093 / humrep / dev316
PubMed Аннотация | CrossRef Полный текст | Google Scholar
17. Тофтагер М., Богстад Дж., Лёссл К., Прэториус Л., Зеделер А., Бриндорф Т. и др. Кумулятивная частота живорождений после одного цикла АРТ, включая все последующие циклы замораживания-оттаивания у 1050 женщин: вторичный результат РКИ, сравнивающего протоколы антагонистов ГнРГ и агонистов ГнРГ. Hum Reprod (2017) 32 (3): 556–67. DOI: 10.1093 / humrep / dew358
PubMed Аннотация | CrossRef Полный текст | Google Scholar
18.Filicori M, Cognigni GE, Pocognoli P, Tabarelli C, Spettoli D, Taraborrelli S и др. Модуляция фолликулогенеза и стероидогенеза у женщин путем постепенного введения менотропина. Hum Reprod (2002) 17 (8): 2009–15. DOI: 10.1093 / humrep / 17.8.2009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
19. Ku SY, Suh CS, Kim SH, Choi YM, Kim JG, Moon SY. Пилотное исследование использования низких доз менопаузального гонадотропина человека для индукции овуляции. Eur J Obstet Gynecol Reprod Biol (2003) 109 (1): 55–9.DOI: 10.1016 / S0301-2115 (02) 00476-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
20. Ферраретти А.П., Джанароли Л., Магли М.К., Д’Анджело А., Фарфалли В., Монтанаро Н. Экзогенный лютеинизирующий гормон в контролируемой гиперстимуляции яичников для методов вспомогательной репродукции. Fertil Steril (2004) 82 (6): 1521–6. DOI: 10.1016 / j.fertnstert.2004.06.041
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Коджак М., Дилбаз Б., Демир Б., Таши Ю., Таркан А., Деде С. и др.Лиофилизированный чМГ по сравнению с рФСГ у женщин с необъяснимым бесплодием, подвергающихся контролируемой стимуляции яичников с помощью внутриматочной инсеминации: проспективное рандомизированное исследование. Гинекол Эндокринол (2010) 26 (6): 429–34. DOI: 10.3109 / 095135632175
PubMed Аннотация | CrossRef Полный текст | Google Scholar
22. Саннелла Ф., Моро Ф., Ланзоне А, Тропея А, Мартинес Д., Капальбо А. и др. Проспективное рандомизированное исследование не меньшей эффективности, сравнивающее рекомбинантный ФСГ и высокоочищенный менотропин в циклах внутриматочного осеменения у пар с необъяснимым бесплодием и / или умеренно-умеренным мужским фактором. Fertil Steril (2011) 95 (2): 689–94. DOI: 10.1016 / j.fertnstert.2010.08.044
PubMed Аннотация | CrossRef Полный текст | Google Scholar
23. Rashidi M, Aaleyasin A, Aghahosseini M, Loloi S, Kokab A, Najmi Z. Преимущества рекомбинантного фолликулостимулирующего гормона перед менопаузальным гонадотропином человека для стимуляции яичников при внутриматочной инсеминации: рандомизированное клиническое испытание при необъяснимом бесплодии. Eur J Obstet Gynecol Reprod Biol (2013) 169 (2): 244–7.DOI: 10.1016 / j.ejogrb.2013.03.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Моро Ф., Скаринчи Э., Палла С., Романи Ф., Фамилиари А, Тропея А и др. Высокоочищенный чМГ по сравнению с рекомбинантным ФСГ плюс рекомбинантный ЛГ в циклах внутриматочной инсеминации у женщин> / = 35 лет: рандомизированное контролируемое исследование. Hum Reprod (2015) 30 (1): 179–85. DOI: 10.1093 / humrep / deu302
CrossRef Полный текст | Google Scholar
25. Мюллер Т., Громолл Дж., Симони М. Отсутствие экзона 10 рецептора лютеинизирующего гормона (ЛГ) человека ухудшает действие ЛГ, но не действие хорионического гонадотропина человека. J Clin Endocrinol Metab (2003) 88 (5): 2242–9. DOI: 10.1210 / jc.2002-021946
CrossRef Полный текст | Google Scholar
26. Гжесик П., Тайхманн А., Фуркерт Дж., Рутц С., Визнер Б., Кляйнау Г. и др. Различия между активацией рецепторов, опосредованной лутропином и хориогонадотропином. FEBS J (2014) 281 (5): 1479–92. DOI: 10.1111 / febs.12718
PubMed Аннотация | CrossRef Полный текст | Google Scholar
27. Grzesik P, Kreuchwig A, Rutz C, Furkert J, Wiesner B, Schuelein R, et al.Различия в активации сигнала ЛГ и ХГЧ опосредуются внеклеточной шарнирной областью рецептора ЛГ / ХГ. Передний эндокринол (2015) 6: 140. DOI: 10.3389 / fendo.2015.00140
PubMed Аннотация | CrossRef Полный текст | Google Scholar
28. Huhtaniemi IT, Catt KJ. Дифференциальная аффинность связывания рецепторов лютеинизирующего гормона семенников крысы (ЛГ) с хорионическим гонадотропином человека, ЛГ человека и ЛГ овцы. Эндокринология (1981) 108 (5): 1931–8. DOI: 10.1210 / эндо-108-5-1931
CrossRef Полный текст | Google Scholar
29.Гупта С., Чапекар Т., Чхабра Ю., Сингх П., Синха С., Лутра К. Дифференциальный ответ на устойчивую стимуляцию ХГЧ и ЛГ на клетках гранулезы яичников коз. Indian J Med Res (2012) 135: 331–40.
Google Scholar
30. Амстердам А., Голд Р.С., Хосокава К., Йошида Ю., Сассон Р., Юнг Ю. и др. Перекрестные помехи между множественными сигнальными путями, контролирующими гибель клеток яичников. Trends Endocrinol Metab (1999) 10 (7): 255–62. DOI: 10.1016 / S1043-2760 (99) 00164-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
31.Casarini L, Reiter E, Simoni M. β-аррестины регулируют пролиферацию клеток, опосредованную рецептором гонадотропина, и апоптоз, контролируя различную внутриклеточную передачу сигналов FSHR или LHCGR в клеточной линии hGL5. Mol Cell Endocrinol (2016) 437: 11–21. DOI: 10.1016 / j.mce.2016.08.005
CrossRef Полный текст | Google Scholar
32. Zech NH, Zech M, Baldauf S, Comploj G, Murtinger M, Spitzer D, et al. Стимуляция яичников в ВРТ - снятие насущных проблем. Минерва Гинеколь (2015) 67 (2): 127–47.
PubMed Аннотация | Google Scholar
33. Детти Л., Саед Г.М., Флетчер Н.М., Крюгер М.Л., Броссойт М., Даймонд М.П. Морфология эндометрия и модуляция рецепторов гормонов во время стимуляции яичников для циклов вспомогательных репродуктивных технологий. Fertil Steril (2011) 95 (3): 1037–41. DOI: 10.1016 / j.fertnstert.2010.12.025
PubMed Аннотация | CrossRef Полный текст | Google Scholar
34. Dewailly D, Robin G, Peigne M, Decanter C, Pigny P, Catteau-Jonard S.Взаимодействие между андрогенами, ФСГ, антимюллеровым гормоном и эстрадиолом во время фолликулогенеза в нормальных и поликистозных яичниках человека. Обновление Hum Reprod (2016) 22: 709–22. DOI: 10.1093 / humupd / dmw027
CrossRef Полный текст | Google Scholar
35. Тинг А.Ю., Сюй Дж., Стоуфер Р.Л. Дифференциальные эффекты эстрогена и прогестерона на развитие вторичных фолликулов приматов в обедненной стероидами среде in vitro. Hum Reprod (2015) 30 (8): 1907–17. DOI: 10.1093 / humrep / dev119
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Ezcurra D, Humaidan P. Обзор лютеинизирующего гормона и хорионического гонадотропина человека при использовании в вспомогательных репродуктивных технологиях. Репрод Биол Эндокринол (2014) 12:95. DOI: 10.1186 / 1477-7827-12-95
PubMed Аннотация | CrossRef Полный текст | Google Scholar
37. Lehert P, Schertz JC, Ezcurra D. Рекомбинантный человеческий фолликулостимулирующий гормон производит больше ооцитов с более низкой общей дозой за цикл в вспомогательных репродуктивных технологиях по сравнению с высокоочищенным менопаузальным гонадотропином человека: метаанализ. Reprod Biol Endocrinol (2010) 8: 112. DOI: 10.1186 / 1477-7827-8-112
PubMed Аннотация | CrossRef Полный текст | Google Scholar
38. Аль-Инани Х.Г., Юсеф М.А., Айелек Р.О., Браун Дж., Лам В.С., Брокманс Ф.Дж. Антагонисты гонадотропин-рилизинг-гормона для вспомогательных репродуктивных технологий. Кокрановская база данных Syst Rev (2016) 4: CD001750. DOI: 10.1002 / 14651858.CD001750.pub4
PubMed Аннотация | CrossRef Полный текст | Google Scholar
40. Рабинсон Дж., Мельцер С., Зохав Е., Гемер О., Антеби Е. Ю., Орвието Р.Агонист ГнРГ по сравнению с антагонистом ГнРГ при стимуляции яичников: влияние индекса массы тела на исход экстракорпорального оплодотворения. Fertil Steril (2008) 89 (2): 472–4. DOI: 10.1016 / j.fertnstert.2007.03.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
41. Беркканоглу М., Озгур К. Какова оптимальная максимальная доза гонадотропина, используемая в циклах обострения микродоз у пациентов с плохим ответом? Fertil Steril (2010) 94 (2): 662–5. DOI: 10.1016 / j.fertnstert.2009.03.027
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43. Fauser BC, Devroey P. Почему клиническое признание одновременного лечения антагонистами гонадотропин-рилизинг-гормона во время гиперстимуляции яичников для экстракорпорального оплодотворения так медленно? Fertil Steril (2005) 83 (6): 1607–11. DOI: 10.1016 / j.fertnstert.2005.02.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
44. Джанароли Л., Раковски С., Гераедтс Дж., Кедры М., Макригианнакис А., Лобо Р.А.Лучшие практики ASRM и ESHRE: путешествие по репродуктивной медицине. Fertil Steril (2012) 98 (6): 1380–94. DOI: 10.1016 / j.fertnstert.2012.07.1164
PubMed Аннотация | CrossRef Полный текст | Google Scholar
45. La Marca A, Sunkara SK. Индивидуализация контролируемой стимуляции яичников при ЭКО с использованием маркеров резерва яичников: от теории к практике. Обновление Hum Reprod (2014) 20 (1): 124–40. DOI: 10.1093 / humupd / dmt037
PubMed Аннотация | CrossRef Полный текст | Google Scholar
46.Reindollar RH, Regan MM, Neumann PJ, Levine BS, Thornton KL, Alper MM и др. Рандомизированное клиническое исследование для оценки оптимального лечения бесплодия необъяснимой природы: ускоренное и стандартное лечение (FASTT). Fertil Steril (2010) 94 (3): 888–99. DOI: 10.1016 / j.fertnstert.2009.04.022
PubMed Аннотация | CrossRef Полный текст | Google Scholar
47. Голдман М.Б., Торнтон К.Л., Райли Д., Альпер М.М., Фунг Дж.Л., Хорнштейн М.Д. и др. Рандомизированное клиническое испытание для определения оптимального лечения бесплодия у пожилых пар: испытание «Сорок и больше лечения» (FORT-T). Fertil Steril (2014) 101 (6): e1571–2. DOI: 10.1016 / j.fertnstert.2014.03.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Crawford S, Boulet SL, Mneimneh AS, Perkins KM, Jamieson DJ, Zhang Y, et al. Стоимость достижения живорождения с помощью вспомогательных репродуктивных технологий: сравнение подходов последовательного переноса одиночного и двойного эмбриона. Fertil Steril (2016) 105 (2): 444–50. DOI: 10.1016 / j.fertnstert.2015.10.032
PubMed Аннотация | CrossRef Полный текст | Google Scholar
49.Хумайдан П., Чин В., Рогофф Д., Д'Хуг Т., Лонгобарди С., Хаббард Дж. И др. Эффективность и безопасность фоллитропина альфа / лутропина альфа при АРТ: рандомизированное контролируемое исследование с участием малоэффективных яичников. Hum Reprod (2017) 32 (3): 544–55. DOI: 10.1093 / humrep / dew360
PubMed Аннотация | CrossRef Полный текст | Google Scholar
50. Папатанасиу А., Сирл Б. Дж., Кинг Н. М., Бхаттачарья С. Тенденции в исследованиях «плохих респондентов»: уроки, извлеченные из рандомизированных контролируемых исследований по вспомогательному зачатию. Обновление Hum Reprod (2016) 22 (3).DOI: 10.1093 / humupd / dmw001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Определение «зоны наилучшего восприятия» для введенных соотношений лютеинизирующего гормона и фолликулостимулирующего гормона гонадотропина во время стимуляции яичников для защиты от клинически значимого позднего фолликулярного увеличения прогестерона: анализ 10 280 первых циклов экстракорпорального оплодотворения
Цель
Чтобы определить, влияют ли различные соотношения вводимого ЛГ к ФСГ на риск клинически значимого позднего повышения уровня P в фолликулах и существует ли оптимальный диапазон отношения ЛГ к ФСГ для снижения этого риска.
Дизайн
Ретроспективная когорта.
Окружение
Частный академический центр.
Пациенты
Всего 10 280 пациентов прошли первый цикл ЭКО.
Основные показатели результата
Отношение экзогенного ЛГ к ФСГ во время стимуляции и связь с абсолютным уровнем P в сыворотке ≥1,5 нг / мл в день введения ХГЧ.
Результат (ы)
Стимуляции без введения ЛГ (N = 718) имели самый высокий риск повышения P ≥1.5 нг / мл (относительный риск [ОР] = 2,0; 95% доверительный интервал [ДИ] 1,8–2,2). Наименьший риск повышения P наблюдался при соотношении ЛГ к ФСГ 0,30: 0,60 (20%; N = 4732). Напротив, отношения <0,30, отражающие пропорционально меньшее количество вводимого ЛГ (N = 4847), имели повышенный риск преждевременного повышения P (32%, ОР = 1,6; 95% ДИ 1,5–1,7), как и отношения> 0,60 (23%, ОР). 1,1; 95% ДИ 1,0–1,3). Эта модель наименьшего риска в диапазоне 0,30–0,60 сохраняется для циклов, характеризующихся низкой, нормальной и высокой реакцией.При выполнении логистической регрессии для контроля нескольких мешающих переменных эта взаимосвязь сохранялась.
Заключение (-я)
Отсутствие или недостаточное дозирование ЛГ связано с риском позднего повышения уровня P в фолликулах, достаточного для получения неоптимальных результатов. Общее соотношение ЛГ к ФСГ 0,30: 0,60 было связано с самым низким риском повышения Р. При принятии решения о дозировке гонадотропина следует учитывать оптимизацию этого параметра.
Ключевые слова
Гонадотропины
позднее фолликулярное повышение прогестерона
экзогенный ЛГ
экзогенный ФСГ
стимуляция
Рекомендуемые статьиЦитирующие статьи (0)
Просмотреть аннотациюCopyright © 2014 Авторы.Опубликовано Elsevier Inc.
Рекомендуемые статьи
Цитирование статей
JCM | Бесплатный полнотекстовый | Действие фолликулостимулирующего гормона (ФСГ) на сперматогенез: внимание к физиологической и терапевтической роли
1. Введение
Гипофиз регулирует репродуктивную функцию человека посредством усовершенствованного комбинированного действия фолликулостимулирующего гормона (ФСГ) и лютеинизирующего гормона (ЛГ) на гонадах. При транспортировке в кровотоке ФСГ достигает гонад, стимулируя развитие фолликулов у женщин и сперматогенез у мужчин.
Хотя роль ФСГ в репродуктивной физиологии у обоих полов очевидна, его терапевтическое использование для лечения бесплодия остается сомнительным, особенно у мужчин. ФСГ в основном используется в терапевтическом контексте методов вспомогательной репродукции (ВРТ) для стимулирования мультифолликулярного роста у женщин, в то время как эффективность введения ФСГ у бесплодных мужчин неясна. На клинических картинах, характеризующихся недостаточным уровнем ФСГ, таких как мужской гипогонадотропный гипогонадизм (ГГ), восстановление действия ФСГ улучшает количественные и качественные параметры сперматозоидов и, следовательно, фертильность [1].Терапевтический подход к мужскому HH направлен на восстановление физиологического функционирования яичек и может быть получен путем введения гонадотропин-рилизинг-гормона (GnRH), который опосредует эндогенную продукцию гипофиза как FSH, так и LH. Надлежащие уровни гонадотропина в сыворотке также могут быть достигнуты путем экзогенного введения этих гормонов, обычно хорионического гонадотропина человека (ХГЧ), который, действуя на один и тот же мембранный рецептор ЛГ, ЛГКР, долгое время считался идентичным ЛГ [2] .Введение ХГЧ может поддерживаться добавлением активности ФСГ с фоллитропинами, полученными из мочи или рекомбинантными [3]. Предполагается, что у пациентов с ГГ повышение уровня гонадотропина в сыворотке полезно для мужской фертильности, поскольку улучшение параметров сперматозоидов будет иметь положительный эффект. влияние на частоту наступления беременности. Хотя полное восстановление нормальных параметров спермы, как правило, не достигается у мужчин с HH (в зависимости от причин HH) [4] и даже не является необходимым для зачатия, лечения гонадотропинами достаточно для стимуляции сперматогенеза [1] и является обоснованием для использования, даже если эмпирически, ФСГ, с ХГЧ или без него, при мужском идиопатическом бесплодии, которое считается формой «функционального» гипогонадизма.По аналогии с терапевтическими преимуществами, наблюдаемыми у мужчин HH, введение экзогенного ФСГ было предложено мужчинам с измененной выработкой спермы и уровнями ФСГ в пределах нормального диапазона, предполагая его способность увеличивать выработку сперматозоидов [5].В настоящем обзоре мы оцениваем физиологическую роль ФСГ в сперматогенезе, подчеркивая его синергическое действие с тестостероном. Эти концепции являются фундаментальными для понимания потенциальных фармакологических преимуществ введения ФСГ в клинической практике.
2. Физиологический контроль сперматогенеза
Сперматогенез происходит в семенных канальцах семенников ступенчатым образом, требуя аутокринных, паракринных и эндокринных стимулов, которые контролируются действием как ФСГ, так и ЛГ [6,7]. ФСГ - это гликопротеин, состоящий из двух субъединиц: альфа, общего с другими гликопротеиновыми гормонами, и бета (ФСГβ). Человеческий FSHβ кодируется геном FSHB, расположенным на хромосоме 11p21 [8]. Благодаря взаимодействию со своим рецептором (FSHR) [9], FSH воздействует на свою уникальную мишень в мужских клетках, а именно на клетки Сертоли, расположенные в основании семенных канальцев яичка [10,11].Эти клетки создают нишу, в которой сперматогонии пролиферируют и созревают [10,11]. Клетки Сертоли связаны друг с другом и с соседними зародышевыми клетками щелевыми контактами, что обеспечивает обмен метаболитами. Важно отметить, что плотные соединения, расположенные в их основе, образуют гемато-семенниковый барьер, изолируя мейотические и постмейотические половые клетки от кровотока. В клетках Лейдига ЛГ стимулирует выработку тестостерона через взаимодействие со своим специфическим рецептором, LHCGR [12]. Концентрация тестостерона в яичках в 50–100 раз выше, чем в периферическом кровообращении [12].Все эти аспекты указывают на важность среды семенников для поддержки и поддержания сперматогенетической функции [13,14]. Физиологическая роль ФСГ в регуляции сперматогенеза оценивалась на различных моделях животных. У грызунов ФСГ определяет окончательное количество клеток Сертоли в период полового созревания, стимулируя пролиферацию клеток во время эмбриональной и неонатальной жизни, тогда как у приматов эта митотическая функция наблюдается на неонатальной и перипубертатной стадиях [15]. Соответственно, в раннем возрасте ФСГ стимулирует транскрипцию генов, участвующих как в репликации ДНК, так и в регуляции клеточного цикла [16].У людей FSHR сначала экспрессируется во второй половине беременности, но его активация происходит после начала секреции FSH у новорожденного [17]. Затем перипубертатный подъем ФСГ стимулирует пролиферацию клеток Сертоли [15]. В зрелом возрасте ФСГ заставляет клетки Сертоли производить регуляторные молекулы и питательные вещества, необходимые для сперматогенеза [18]. В частности, ФСГ активирует транскрипцию генов, участвующих в метаболическом гомеостазе, и поддерживает функции половых клеток [16] с синтезом ретиноевой кислоты, лактата, активатора плазминогена 2 типа, а также метаболизм жирных кислот и митохондриальный биогенез [19,20] .Уровни циркулирующего ФСГ напрямую коррелируют с количеством клеток Сертоли и объемом яичек у взрослых [21]. Помимо известного действия ФСГ на пролиферацию клеток Сертоли, точная роль этого гонадотропина в сперматогенезе остается в значительной степени неясной. Генетически модифицированные мышиные модели были полезны для лучшего понимания того, как ФСГ регулирует сперматогенез. В частности, в семенниках взрослых мышей ФСГ стимулирует клетки Сертоли к выработке антиапоптотических факторов выживания и молекул адгезии, способствующих созреванию зародышевых клеток [22,23].Однако абсолютный недостаток ФСГ или ФСГР, несмотря на снижение количества клеток Сертоли, не приводит ни к азооспермии, ни к бесплодию [24,25]. Фактически, мыши с нокаутом Fshb или Fshr (KO) уменьшили, но все же продолжали производство спермы. Точнее, отсутствие действия ФСГ приводит к снижению количества клеток Сертоли, но созревание зародышевых клеток сохраняется, несмотря на снижение количества сперматогониев и сперматоцитов. Имея это в виду, животные модели предполагают, что ФСГ необходим для того, чтобы вызывать пролиферацию клеток Сертоли и поддерживать количество зародышевых клеток, вероятно, благодаря способности клеток Сертоли питать зародышевые клетки, тогда как его действие необходимо для завершения сперматогенеза.Поскольку эндокринная регуляция гонадных функций у мышей может отличаться от людей, данные, полученные на моделях грызунов, следует рассматривать в их контексте. В некоторых случаях инактивация гомозиготных мутаций FSHR у людей была связана с бесплодными мужскими фенотипами [26], хотя эти мутации очень редки, и этот вопрос является предметом обсуждения [25,27] и требует дополнительных исследований. Однако стоит также отметить, что инактивирующая мутация A189V связана с мужской олигозооспермией / субфертильностью, не обязательно с азооспермией [28].В научной литературе имеется множество доказательств, демонстрирующих центральную роль ЛГ в поддержке сперматогенеза посредством индукции интратестикулярной продукции тестостерона. Действительно, модели мышей с рецептором LH (Lhr) -KO не имеют продукции тестостерона и демонстрируют нарушение прогрессирования сперматогенеза [29], которое восстанавливается после замены тестостерона [30]. Таким образом, в отличие от ФСГ, отсутствие ЛГ-зависимой выработки тестостерона приводит к азооспермии, что позволяет предположить, что тестостерон строго необходим для производства спермы.Эти экспериментальные модели предполагают, что количественно и качественно нормальный сперматогенез требует действия интратестикулярного тестостерона в синергии с ФСГ. Существование синергизма между тестостероном и ФСГ также подтверждается исследованиями in vitro, поскольку и тестостерон, и ФСГ регулируют экспрессию генов, участвующих в развитие и функции гематоэнцефалического барьера, в то время как ФСГ поддерживает организацию плотных контактов и эктоплазматическую специализацию [16,31,32], предполагая, что синергетическое действие ФСГ и тестостерона регулирует разные уровни сперматогенных процессов [33].Новое понимание природы этой синергии было получено с помощью мутации Fshr-D580H у фоновых мутантных мышей Lhr-KO [34]. Мутация Fshr-D580H, приводящая к конститутивной активации Fshr, обратила азооспермию из-за отсутствия действия LH, полученного путем делеции гена Lhr, в сочетании с блокадой остаточной активности тестостерона антиандрогенным флутамидом [34]. Эти данные демонстрируют, что конститутивная активация опосредованной Fshr передачи сигналов может преодолевать отсутствие путей, опосредованных как LH, так и тестостероном.Фактически, непрерывная гиперактивация ФСГ-подобных сигналов поддерживает транскрипцию андроген-зависимых генов и активирует сперматогенный путь независимо от ЛГ и тестостерона [34]. В целом, существующая литература по другим моделям на животных предполагает, что сигналы, индуцированные гонадотропины могут быть неспецифическими и избыточными, поскольку у некоторых видов сперматогенез происходит в отсутствие ФСГ [24,25], что указывает на то, что действие интратестикулярного тестостерона достаточно для поддержания производства спермы в физиологических условиях.Хотя эти эффекты могут иметь место только в определенных экспериментальных условиях [35,36], предполагается, что ФСГ играет плейотропную роль в гаметогенезе. Эта регуляция гонад, зависимая от ФСГ, будет зависеть от пола, поскольку гормон вместо этого необходим для роста фолликулов за пределами преантральной стадии у женщин [25]. У людей физиологическая структура, в которой действует ФСГ, еще более сложна [37]. , а эффективное действие гормона на сперматогенез остается малоизученным. Немногочисленные данные, описывающие эффекты нарушения действия ФСГ у человека, предоставлены мутациями, инактивирующими ФСГ [28] и ФСГБ [38].Редкие мутации FSHR, описанные у мужчин, предполагают, что они приводят к снижению фертильности с уровнем тестостерона в пределах физиологического диапазона и снижению сперматогенеза, но не обязательно к азооспермии. Этот результат отражает клиническую картину на моделях мышей Fshr-KO, предполагая, что сперматогенез может происходить в отсутствие надлежащего действия ФСГ также у людей, в то время как азооспермия встречается во всех случаях инактивации мутаций ФСГ, описанных до сих пор [38]. Однако, учитывая небольшое количество мутаций FSHB и FSHR, описанных у мужчин, мы в настоящее время не можем прояснить точную роль FSH в сперматогенезе человека.Человеческие инактивирующие мутации LHCGR или LH бета (LHB) связаны с 46 XY расстройствами полового развития (DSD) фенотипически в диапазоне от полной феминизации до менее серьезных или отсутствующих сексуальных аномалий [39]. В некоторых случаях дефекты передачи сигналов ЛГ, не полностью подавляющие действие гормона, приводят к олигозооспермии и низким уровням интратестикулярного тестостерона, но не к азооспермии [40,41]. Таким образом, в присутствии физиологической продукции ФСГ очень низкие уровни ЛГ могут быть достаточными для поддержания интратестикулярного тестостерона и выработки спермы у людей.Эти данные могут указывать на возможное синергическое действие ФСГ и ЛГ, основанное на избыточности сигнального аппарата гонадотропинов [42,43]. С другой стороны, активирующие мутации LHCGR у человека приводят к повышению уровня тестостерона, связанного с непрерывной выработкой сперматозоидов, несмотря на снижение уровня ФСГ [42]. Можно предположить, что в ходе эволюции сперматогенез поддерживался при частичной зависимости как от ФСГ, так и от ЛГ, по крайней мере, у некоторых видов [44], обеспечивая производство спермы, несмотря на потерю действия одного гонадотропина.Информация о физиологической роли ФСГ в сперматогенезе поступает из моделей гемикастрации у млекопитающих, включая приматов, где происходит значительно увеличенный объем контралатерального яичка [45,46,47,48,49]. Учитывая, что количество взрослых клеток Сертоли не изменяется, увеличение размера яичек обоснованно связано с увеличением количества половых клеток [49]. Односторонняя орхиэктомия приводит к снижению уровня ингибина B, что приводит к увеличению эндогенного ФСГ и поддержке выработки спермы за счет усиления стимуляции пролиферации B-сперматогоний [49].Подобные данные были описаны у мужчин после удаления яичка со злокачественными клетками, где произошла контралатеральная гипертрофия яичка [45]. В этом случае гормональная секреция яичек и продукция спермы вернулись к физиологическим уровням в течение 120 дней после гемикастрации, подтверждая компенсаторное усиление сперматогенеза в оставшихся яичках [45]. Эти данные подтверждаются исследованиями пациентов с аденомами гипофиза, секретирующими ФСГ, которые показали повышенное увеличение яичек, вероятно, из-за чрезмерной стимуляции ФСГ, даже если это происходит после полового созревания [50].Таким образом, человеческий сперматогенез (рис. 1) физиологически регулируется как действием ФСГ, так и синергетически с помощью ЛГ-зависимого внутри-тестикулярного тестостерона, который, в свою очередь, действует в клетках Сертоли через ядерный рецептор андрогенов (AR). Эти механизмы реализуются через активацию частично перекрывающихся внутриклеточных сигнальных путей, поскольку отсутствие любого гонадотропина не обязательно определяет азооспермию. Однако качественно и количественно адекватный сперматогенез требует действия ФСГ и высоких уровней интратестикулярного тестостерона, действующих аддитивным и синергетическим путями [51].Эти данные открывают новые перспективы в терапевтических подходах к мужскому бесплодию, аналогично тому, что в настоящее время делается у женщин, получающих АРТ [52].3. Механизм действия ФСГ в клетке Сертоли
Многие исследования были нацелены на расшифровку сигнальных путей, индуцируемых ФСГ от рождения до полового созревания, чтобы получить представление о динамике, которая управляет переключением между митотической и дифференцирующей функциями гормона. Связывание FSHR с α-субъединицей G-белка (Gα s ) / циклическим аденозинмонофосфатом (цАМФ) / цАМФ-зависимой протеинкиназой А (PKA) / цАМФ-зависимым белком, связывающим элементы (CREB), было признано единственный эффекторный механизм ФСГ более сорока лет [53].В клетках Сертоли ФСГ регулирует внутриклеточную концентрацию цАМФ в результате равновесия между его синтезом аденилатциклазой и скоростью разложения фосфодиэстеразами (ФДЭ) [54,55,56]. Внутриклеточная концентрация вторичных мессенджеров также точно регулируется за счет десенсибилизации FSHR, которая происходит в течение нескольких минут после воздействия FSH [57,58], и это приводит к разъединению рецептора, связанного с лигандом, от G-белков. Обработка клеток Сертоли in vitro ФСГ приводит к рекрутированию на рецептор киназ, нацеленных на рецептор, сопряженный с G-белком (GPCR), а именно киназы сопряженных с G-белком рецепторов (GRK) [57,58].Затем β-аррестины рекрутируются в FSHR в результате как фосфорилирования, так и вызванных агонистами конформационных изменений рецептора. β-аррестины способствуют интернализации благодаря своей способности взаимодействовать с компонентами ямок, покрытых клатрином. Этот процесс десенсибилизации имеет очевидное физиологическое значение, потому что в живом организме клетки Сертоли постоянно подвергаются воздействию ФСГ, являясь рецептором, локализованным на базальном полюсе клетки, в контакте с базальной пластинкой и кровеносными капиллярами (рис. 2).В начале 2000-х годов был сделан ряд открытий, которые показали, что ФСГ на самом деле индуцирует сложную сеть молекулярных взаимодействий внутри клетки, которая значительно превосходит передачу сигналов, зависящих от G-белка. Связывание FSHR с сигнальным путем Gα s / cAMP / PKA теперь рассматривается как один из нескольких механизмов, способствующих активации всей индуцированной гормоном сигнальной сети, где сосуществуют цАМФ-зависимая и цАМФ-независимая передача сигналов. . В клетках Сертоли беспорядочная связь G-белка была продемонстрирована как единственный способ стимулировать цАМФ-независимую передачу сигналов.Например, FSHR связывается не только с Gα s , но также и с Gα i , который участвует в постнатальном митотическом ответе клеток Сертоли на FSH через внеклеточную регулируемую киназу (ERK) / митоген-активируемую протеинкиназу. (MAPK) -зависимая сигнализация [59]. Эти данные подтверждаются недавними данными о том, что ФСГ ограничивает экспрессию Gα s , который не может подавлять активность Gα i у новорожденных приматов [60]. В этой строке динамическая вычислительная модель предсказала, что ингибирование PKA не нарушает продукцию фосфатидилинозитида (3,4,5) трифосфата (PIP3) у крыс препубертатного возраста [61].PKA-независимость этого пути была подтверждена экспериментально путем изучения активации протеинкиназы B (PKB / Akt), мишени PIP3-киназы (PI3K) в клетках Сертоли [62]. ERK и Akt регулируются FSH противоположным образом во время постнатального развития клеток Сертоли [59,61]. Тирозинкиназный рецептор фосфатазы Src homology 2, содержащая фосфотирозинфосфатаза (Shp2), вероятно, участвует в этой двойной регуляции ERK и Akt с помощью ФСГ, и нарушение этого пути у мышей с нокаутом Shp2 приводит к бесплодию из-за аномалий в крови - барьер семенников и преждевременное истощение популяции половых клеток [63].Многочисленные исследования с использованием иммортализованных клеточных линий открыли возможность того, что β-аррестины могут быть основным каркасом для многих сигнальных модулей GPCRs в целом [64] и FSHR в частности [65,66,67]. Их действие важно, потому что они последовательно определяют кинетику профиля активации ERK, который более устойчив, чем временная Gs-опосредованная активация ERK [65]. Напротив, β-аррестины и Gα s действуют совместно, стимулируя рибосомный белок S6 киназу бета-1 (p70S6K) в ответ на ФСГ в комплексе, включающем один из субстратов фермента (рибосомный белок S6) [68].Хотя p70S6K и β-аррестин 1 идентифицированы в общих белковых комплексах в клетках Сертоли, на сегодняшний день роль, которую β-аррестины могут играть в качестве регуляторов кинетики и пространственной организации ФСГ-зависимой сигнальной сети, окончательно не доказана в этих клетках. . Однако тот факт, что мужчины-олигозооспермы, несущие инактивирующую мутацию Ala189Val в FSHR, сохраняют β-аррестин-зависимую, но независимую от цАМФ передачу сигналов [69], предполагает, что β-аррестины могут играть роль в поддержании фертильности.Поразительно, что в клетках Сертоли уровни вторичных мессенджеров, по-видимому, регулируются в процессе развития, при этом эффективность продукции цАМФ, индуцированной ФСГ, возрастает от рождения до половой зрелости [59], тогда как чувствительность продукции PIP3 к ФСГ со временем снижается [70]. Напр., В клетках Сертоли, стимулированных ФСГ, p70S6K регулируется посредством тонкого взаимодействия между PKA- и PI3K-зависимой передачей сигналов, которая действует регулируемым путем развития способом [70]. PIP3-зависимые молекулярные события, такие как мишень рапамицина у млекопитающих (mTOR) и богатый пролином субстрат Akt с фосфорилированием 40 кДа (PRAS-40), по-видимому, участвуют в митогенном ответе на ФСГ, тогда как 5'-AMP-активированный белок киназа (AMPK), фосфатаза и гомолог тензина (PTEN) противодействуют этому эффекту [71,72].Однако механизмы, посредством которых FSHR соединяется с регуляцией PIP3, все еще неясны. Сигнальная сеть FSH определяет содержание белка в гонадных клетках посредством долгосрочных регуляций транскрипции, на которые непосредственно влияют транскрипционные факторы или ремоделирование хроматина, а также посредством краткосрочных посттранскрипционных регуляций. на уровне трансляции РНК-мессенджера (мРНК) и оборота микроРНК (миРНК). Анализ ДНК-микрочипов обработанных ФСГ препубертатных клеток Сертоли in vitro выявил влияние на устойчивый уровень многих целевых мРНК уже через 2 часа лечения [73].Подавление ФСГ с помощью четырехдневной пассивной иммунизации нейтрализующими АТ привело к идентификации регулируемых гормонами транскриптов, среди которых есть хорошо известные гены, чувствительные к ФСГ в клетках Сертоли, включая гены, участвующие в клеточном цикле и регуляции выживания, такие как циклин. D1. Сопоставимые результаты были получены на гипогонадальных (hpg) мышах, что является удобной моделью для анализа влияния экзогенно вводимого ФСГ на регуляцию генов in vivo [74,75]. Недавно ландшафт экспрессии регулируемых ФСГ генов был описан не только в клетках Сертоли новорожденных или препубертатных крыс, но также и у взрослых, когда эти клетки полностью обеспечивают метаболическую и физическую поддержку зародышевой линии [76].Как и ожидалось, в незрелых клетках Сертоли гены, участвующие в росте и пролиферации клеток, метаболизме и путях MAPK и Wingless-related сайте интеграции (Wnt) были активированы, тогда как в зрелых клетках гены, относящиеся к дифференцированной функции клеток Сертоли, участвовали в фагоцитозе были выражены ремоделирование цитоскелета, метаболизм глюкозы и передача сигналов инсулина. В этом исследовании ФСГ доставлялся с тестостероном в пульсирующем режиме, как ожидалось, для усиления генных ответов, как описано ранее [60].Это наблюдение очень интересно, потому что оно предполагает, что клетки-мишени гормона декодируют пульсирующий сигнал по сравнению с монотонным сигналом количественно иным образом. Эти транскриптомные анализы предоставили атлас генов, регулируемых передачей сигналов ФСГ in vitro / ex vivo, но они не указывают ни на факторы транскрипции, которые могли бы распознавать регуляторные области генов, ни на вышестоящие сигнальные пути, которые могут быть задействованы. Системный анализ глобальной сети, индуцированной ФСГ, от рецептора до генов-мишеней улучшит наши представления о молекулярном уровне биологических ответов, индуцированных ФСГ.Например, необходимость CREB в регуляции транскрипции должна быть пересмотрена, потому что не так много FSHR-чувствительных генов включают цАМФ-чувствительный элемент (CRE) в свои промоторные области. Следовательно, некоторые PKA-опосредованные транскрипционные ответы могут быть опосредованы другими факторами транскрипции, такими как рецептор ретиноевой кислоты α [77], хорошо известный регулятор развития половых клеток в яичках. Анаболическая роль ФСГ в клетках Сертоли хорошо известна. ; однако весь протеом, индуцированный ФСГ, пока недоступен.Однако в нескольких сообщениях было высказано предположение, что ФСГ регулирует эффективность трансляции ранее существовавшей мРНК в клетках Сертоли от предпубертатных крыс. Например, ФСГ стимулирует путь mTOR / p70S6K, индуцируя фосфорилирование регуляторов инициации трансляции, таких как каркасные белки эукариотического фактора инициации 4B и G (eIF4B и eIF4G, соответственно). Эти молекулярные перестройки связаны с привлечением специфических мРНК к полисомам, таких как мРНК c-fos и фактор роста эндотелия сосудов (VEGF) [61].В соответствии с этой трофической ролью в трансфицированных клетках HEK293, экспрессирующих FSHR, гормон усиливает трансляцию определенного подкласса мРНК, в основном кодирующих белки трансляционного аппарата, 5'TOP, кодирующие мРНК. Однако связанная с полисомами мРНК, идентифицированная с помощью технологии riboTag в семенниках взрослых in vivo, выявила незначительные изменения в количестве мРНК, индуцированных ФСГ [78]. МиРНК составляют настоящую сеть, переплетенную с сетями передачи сигналов в клетке. В этой линии селективный нокаут Сертоли у мышей гена, кодирующего Dicer, фермент, участвующий в процессинге miRNA, раскрыл роль miRNAs в регуляции экспрессии генов, необходимых для мейоза и спермиогенеза [79].Модель на крысах, в которой действие ФСГ и тестостерона подавлялось in vivo, была создана для идентификации сети miRNA при спермии [80], стадии, которая особенно чувствительна к регуляции гормонов. Четыре из регулируемых miRNA, которые были получены в результате анализа микроматрицы miRNA, были комплементарны мРНК PTEN, и гормональный ввод д. Приводил к деградации или ингибированию синтеза этих miRNA, а затем к стабилизации PTEN в спермиогенезе [80]. Интересно, что уровень белка PTEN значительно повышается после стимуляции клеток ФСГ in vitro, что приводит клетки Сертоли к достижению терминальной дифференцировки [71].Поскольку FSH увеличивает уровень белка PTEN в течение нескольких минут, задействованные механизмы, вероятно, происходят посттранскрипционно, предположение согласуется с индуцированной гормонами деградацией miRNA, которая предотвращает накопление PTEN локально в клетках Сертоли. Следовательно, сети miRNA могут регулировать компартментализацию компонентов передачи сигналов ФСГ в клетках Сертоли и контролировать кинетику этих внутриклеточных реакций. Клетки Сертоли представляют собой парадигматическую модель перехода между пролиферативным состоянием и приверженностью к дифференцировке, которая контролируется ФСГ [81,82] и другими факторами, такими как гормоны щитовидной железы [83], которые действуют антагонистически.Эксперименты с семенным нокаутом на мышах продемонстрировали, что гормоны щитовидной железы являются основным сигналом, который останавливает рост Сертоли через α-изоформу рецептора гормонов щитовидной железы [84,85,86]. Локальная аутокринная / паракринная секреция других факторов, таких как нейротрофический фактор глиальных клеток (GDNF) [63], активин A и инсулиноподобный фактор роста (IGF) -I [87], также синергизируют или, по крайней мере, дополняют ФСГ. действие. Устранение in vivo системы IGF (как IGF-R, так и Ins-R нокаут) убедительно доказало, что она необходима для FSH-опосредованного митогенного действия у предпубертатных мышей [88].На основании предыдущих наблюдений можно предположить, что ФСГ, ИФР-I и трийодтиронин (Т3) напрямую влияют на регуляторы клеточного цикла. Например, и ФСГ, и ИФР-I индуцируют экспрессию циклина D1 и D2 [59,88], способствуя прохождению клеточного цикла через фазу G1 и подавляя транскрипцию двух ингибиторов клеточного цикла, а именно, p15 Ink4 ген [88] и, предположительно, ген p21 Cip [89], посредством дефосфорилирования p53 [90]. Этому действию на позитивные регуляторы клеточного цикла противодействует Т3, который подавляет экспрессию циклин-зависимой киназы 4 [91], экспрессия которой повышается с помощью ФСГ в клетках гранулезы [92].T3, вероятно, ингибирует молекулярные события, происходящие в раннем G1, а не позже, потому что ни E, A и циклины B, ни циклин-зависимая киназа 2 (Cdk2) не модулируются с помощью T3 (Figure 3) [84]. Т3 действует не только через рецептор тироидного гормона (TR) α1, но и через митохондриальные рецепторы p43 [84,85,91]. Как указано выше, в ряде исследований установлено, что и ФСГ, и тестостерон являются обязательными для правильного протекания сперматогенеза. Интересно, что недавние исследования соответствующей роли ФСГ и тестостерона посредством клеточно-специфического нокаута соответствующего рецептора показали, что размер популяции клеток Сертоли в первую очередь определяется ФСГ, что делает возможным прогрессирование половых клеток через мейоз вместе с тестостерон [33,93].Стероид также участвует в подавлении пролиферации клеток Сертоли, воздействуя на ингибиторы прогрессирования клеточного цикла [94].4. Генетическая регуляция действия FSH на сперматогенез
Ген, кодирующий FSHR, расположен на хромосоме 2p21, включая десять экзонов и девять интронов [95]. Первые девять экзонов кодируют внеклеточный рецепторный домен, в основном участвующий в связывании лиганда. Экзон 10 кодирует шарнирную область, семь трансмембранных доменов и внутриклеточный карбоксиконцевой хвост [3].Как только FSH связывает внеклеточный домен FSHR, рецептор претерпевает конформационные изменения, активируя несколько внутриклеточных сигнальных путей [96], как описано выше. Таким образом, пространственные конформации FSHR, специфически связанные с однонуклеотидными полиморфизмами (SNP), могут модулировать функциональность рецептора. Более двух тысяч SNP было обнаружено в кодирующих и некодирующих областях гена FSHR, и два из них неоднократно оценивались. Изменение аденозина на гуанин в положении 919 от стартового кодона (c.919A> G; rs6165) и SNP c.2039A> G (rs6166) расположены в экзоне 10 гена FSHR, что приводит к аминокислотным изменениям p.T307A и p.N680S, соответственно, в цепи рецепторного белка [97]. влияние SNP FSHR было впервые описано у мужчин [98], хотя оно широко изучалось у женщин, перенесших вспомогательную репродуктивную функцию. Гомозиготный S (S / S) генотип FSHR p.N680S был связан с более высокими базальными уровнями FSH в сыворотке и с большим количеством ампул FSH, необходимых для достижения аналогичных уровней эстрадиола во время стимуляции яичников по сравнению с p.N680S гомозиготный генотип N (N / N) у 161 овуляторной женщины [99]. Это была первая демонстрация возможной роли SNP в репродукции самок, предполагающая, что присутствие варианта S / S делает FSHR менее чувствительным к FSH [97]. Исследования in vitro на первичных клетках гранулезы человека показали, что полиморфный вариант рецептора опосредует различную кинетику ответа на стимуляцию ФСГ [45]. Действительно, гомозиготный S-вариант FSHR приводит к более медленному увеличению внутриклеточного цАМФ, чем p.N680S гомозиготный вариант рецептора N, хотя аналогичные уровни плато были достигнуты после одного часа лечения [100]. Более того, кинетика цАМФ, специфичная для генотипа FSHR, влияет на активацию других молекул, таких как ERK 1/2 и CREB, экспрессию генов-мишеней и продукцию прогестерона [100], что отражает клинические данные, демонстрирующие, что SNP p.N680S FSHR является маркер ответа яичников на ФСГ [101]. Хотя роль этого SNP в репродукции женщин была дополнительно подтверждена в других исследованиях [102], прошло несколько лет, прежде чем была продемонстрирована его потенциальная роль у мужчин.В 2012 году была произведена первая демонстрация модулирующей активности SNP FSHR p.N680S на мужскую фертильность, в которой сообщалось о более низком объеме яичек в двух больших когортах гомозиготных носителей S p.N680S по сравнению с N / N и гетерозиготными (N / S) пациенты [103,104]. Поскольку для последовательного выявления физиологического эффекта у мужчин требовался относительно большой размер выборки, можно сделать вывод, что SNP p.N680S оказывает слабое влияние на мужскую фертильность [105]. SNP промотора FSHR, опускающийся на 29 нуклеотидов выше транскрипционного стартовый кодон, -29G> A (rs1394205), является другим распространенным полиморфизмом, потенциально влияющим на функцию FSHR [106,107] через модуляцию транскрипционной активности гена [108,109].Интересно, что другие SNP, участвующие в ответе гонад на ФСГ, были идентифицированы в промоторе гена, кодирующего ФСГ. FSHB −211G> T (rs10835638) связан со снижением транскрипции генов и уровнями сывороточного FSH [109]. Многие авторы оценили эффект FSHB c. − 211G> T у обоих полов, обнаружив, что у мужчин он связан с меньшим объемом яичек, количеством сперматозоидов, уровнями тестостерона и ЛГ в сыворотке [104]. Ответ гонад на ФСГ будет зависеть от функционирования и количества ФСГР в клеточной мембране, а также от количества доступного лиганда.Следовательно, комбинация SNP, модулирующих транскрипцию генов FSHR и FSHB и функционирование рецептора, может быть предиктором ответа гонад на гормон in vivo. В недавнем исследовании «случай – контроль» оценивали три SNP FSHR (c.919A> G, c.2039A> G и c. − 29G> A) у 255 бесплодных мужчин и 340 здоровых людей из контрольной группы [110]. Хотя частота аллельных вариантов была схожей между двумя группами, конкретный гаплотип обнаруживался чаще у фертильных мужчин (то есть, аллель -29G> A G, c.Аллель 919A> G A и аллель c.2039A> G A) [110]. Более того, метаанализ двенадцати исследований, доступных в литературе, подтвердил, что наличие аллелей c.919A> GG (p.T307A A) или c.2039A> GG (p.N680S S) связано с повышенным риском мужское бесплодие [110]. Этот результат предполагает, что для вывода комбинаторного вклада SNP FSHR в мужское бесплодие следует рассматривать различные генетические модели, включая доминантные, ко-доминантные и рецессивные модели.Предыдущие исследования, изучающие потенциальную связь между FSHR и SNP FSHB и параметрами мужской фертильности, дали противоречивые результаты, хотя они предполагают, что действие FSH на сперматогенез, вероятно, регулируется комбинированным действием многих SNP [110]. Дальнейшие доказательства могут быть получены в новых исследованиях, в которых сложные гаплотипы рассчитываются с использованием нескольких SNP, входящих даже в состав генов, не участвующих в контроле действия ФСГ. Более того, в доступных исследованиях не собраны все клинические параметры, связанные с фертильностью [110], что ограничивает наше текущее понимание влияния комбинаций SNP на репродуктивную функцию мужчин.Связь между сперматогенетическими фенотипами и генетическим фоном может быть необходима для разработки терапевтических подходов, ориентированных на пациента.5. Терапевтические варианты для улучшения производства спермы
HH представляет собой основной контекст применения ФСГ у мужчин в клинической практике. Это заболевание возникает из-за врожденного или приобретенного нарушения выработки гипоталамического гонадолиберина и / или секреции гонадотропинов гипофизом [111, 112, 113, 114]. Снижение стимуляции гонадотропинами приводит к снижению секреции половых гормонов и выработке спермы.Существуют убедительные доказательства того, что пациенты с ГГ получают пользу от ГнРГ или заместительной терапии гонадотропинами, что приводит к улучшению как сперматогенеза, так и андрогенизации [115, 116]. ГнРГ можно вводить пульсирующе, подкожно через переносной инфузионный насос. Это наиболее физиологический подход к замене стимуляции яичка гонадотропинами. Пульсирующее введение ГнРГ может восстановить развитие вторичных половых признаков у взрослых, нормальный уровень тестостерона в сыворотке и сперматогенез [117,118,119,120].Однако, несмотря на то, что это наиболее физиологический вариант, это лечение не часто используется за пределами узкоспециализированных центров, в основном в Соединенных Штатах, из-за длительного использования внешнего насоса, обслуживание которого может быть неудобным и дорогостоящим. , гонадотропины могут быть напрямую использованы при ДГ. В частности, сообщалось о клинических преимуществах использования только ХГЧ или связанного с ФСГ [121]. В этом контексте недавний метаанализ оценил влияние введения гонадотропина на концентрацию сперматозоидов у субъектов с HH [1].В 10 исследованиях использовался только ХГЧ, в 14 - сопутствующее лечение ХГЧ и ФСГ, а в 23 исследованиях ФСГ вводили в разное время после монотерапии ХГЧ [1]. Полный результат показал положительный эффект всех схем лечения почти у 75% пациентов, учитывая появление хотя бы одного сперматозоида при обычном анализе спермы [1]. Этот эффект был обнаружен при оценке в общей сложности 897 пациентов с ГГ и получен либо с одним ХГЧ, либо с ХГЧ плюс ФСГ, хотя несколько значительно лучший результат был получен при комбинированном действии двух гонадотропинов [1].Этот результат подтверждает, что действие тестостерона внутри яичек необходимо для сперматогенеза, а ФСГ синергетически улучшает этот клинический результат. Однако относительно низкая распространенность ГГ представляет собой главное препятствие для организации крупных исследований, которые позволили бы нам определить лучшую заместительную терапию гонадотропинами для восстановления сперматогенеза в этом контексте. Более того, лечение HH, будь то GnRH или гонадотропинами, требует использования инъекций, которые отягощают пациента, возможно, ограничивая соблюдение и эффективность.Иногда ФСГ предлагается эмпирически у мужчин с идиопатическим бесплодием, у которых патогенез бесплодия четко не установлен. В таких случаях специальное лечение не применимо, и экзогенная стимуляция выработки спермы может быть только эмпирической. Исторически первые попытки стимулировать сперматогенез были предприняты путем введения антагонистов рецепторов эстрогена (то есть тамоксифена и цитрата кломифена). В некоторых странах, особенно в США, антагонисты рецепторов эстрогена используются не по назначению при мужском бесплодии.Высвобождение гипофизом эндогенных ФСГ и ЛГ может быть увеличено путем ингибирования механизма отрицательной обратной связи с использованием модуляторов рецепторов эстрогена (SERM). Недавний метаанализ одиннадцати рандомизированных исследований с участием мужчин с идиопатическим бесплодием показал более высокую частоту наступления беременности в парах, в которых партнер-мужчина лечился с помощью SERM с антагонистической активностью в отношении рецептора эстрогена, по сравнению с парами с нелеченными мужчинами [122]. Этот результат отражается в значительном повышении концентрации и подвижности сперматозоидов после введения SERM, подтверждая, что производство сперматозоидов может быть улучшено за счет увеличения стимуляции гонадотропинами [122].Однако этот результат был получен у ограниченного числа пациентов с гетерогенными клиническими состояниями, что ограничивает вывод в пользу или против применения этого лечения. Соответственно, Кокрановский метаанализ пришел к выводу, что недостаточно доказательств в пользу применения SERM при мужском бесплодии [123]. Потенциальная польза антагонистов рецепторов эстрогена на параметры сперматозоидов может быть объяснена эндогенной «чрезмерной стимуляцией» ФСГ и опосредованным ЛГ увеличением концентрации тестостерона внутри яичек, увеличивая синергетическую стимуляцию ФСГ и ЛГ на производство спермы.Экзогенное введение ФСГ было предложено в качестве возможного терапевтического варианта у бесплодных мужчин с уровнем сывороточного ФСГ в пределах нормы (т.е. ниже 8 МЕ / л), несмотря на то, что это возможно только в некоторых странах [124, 125]. Обоснование этого подхода опирается на попытку чрезмерной стимуляции сперматогенеза, подход, который был исследован на нечеловеческих приматах. Действительно, введение ФСГ обезьянам значительно увеличивало количество бледных сперматогоний типа A [126] и B [127]. Эти исследования показали, что сперматогенез может быть усилен сверх физиологической скорости и может быть дополнительно стимулирован введением ФСГ.Однако окончательная польза от сверхфизиологических уровней ФСГ у людей так и не была четко продемонстрирована. Интересно, что ХГЧ не оказывал никакого эффекта на обезьян [126,127], что свидетельствует о существовании видоспецифической регуляции реакции гонад у приматов. К настоящему времени опубликовано семнадцать клинических испытаний (двенадцать проспективных рандомизированных клинических исследований и пять нерандомизированных исследований) и четыре метаанализа, направленных на определение эффективности ФСГ при мужском идиопатическом бесплодии. Интересно, что использовались гетерогенные по типу и дозировке препараты гонадотропина (таблица 1).Более того, четырнадцать из семнадцати испытаний рассматривали частоту наступления беременности в качестве первичной конечной точки, которая не исключает многих потенциальных предубеждений (то есть статуса фертильности партнерши). Эффективность ФСГ в поддержке сперматогенеза следует оценивать с учетом параметров сперматозоидов в качестве первичной конечной точки. Наконец, большинство этих исследований демонстрируют множество предубеждений, ограничивающих доказательства в пользу эффективности введения ФСГ при мужском идиопатическом бесплодии. Основными ограничениями этих исследований являются выбранный первичный результат, неоднородность дозировок и продолжительности ФСГ (таблица 1), а также критерии включения.Мета-анализ предоставляет обзор опубликованных на данный момент исследований, преодолевая ограниченный размер выборки в каждом исследовании. Однако даже метаанализы иногда основываются на очень ограниченном количестве пациентов. Кокрановское сотрудничество объединило семь исследований, предполагающих окончательное увеличение частоты самопроизвольных беременностей в парах, в которых партнер-мужчина лечился ФСГ [144,145]. Однако эти анализы не выявили значительного увеличения частоты наступления беременности после АРТ [144, 145]. В 2015 г. был проведен второй метаанализ, расширяющий критерии включения и объединяющий пятнадцать испытаний (как рандомизированных, так и нерандомизированных), в которых ФСГ или чМГ вводили партнерам-мужчинам с идиопатическим бесплодием в парах, получающих АРТ [146].Это исследование показало пользу этого лечения для частоты наступления беременности, даже вне контекста АРТ, из-за увеличения общего количества сперматозоидов [146]. Однако эти работы, вместе взятые, охватывают не более 482 пациентов, получавших ФСГ / чМГ, что ограничивает силу этих выводов. Недавно сообщалось о клинической эффективности введения ФСГ при мужском идиопатическом бесплодии, подчеркивая, что дозировка гонадотропина и увеличение количества сперматозоидов имеют положительную корреляцию [147]. Только одно исследование с фармакогенетическим дизайном было направлено на априорную идентификацию тех бесплодных мужчин, которые, как ожидается, ответят на введение ФСГ [105].В этом испытании лечение ФСГ улучшило качество спермы, установленное с учетом индекса фрагментации ДНК сперматозоидов у мужчин-носителей гомозиготного N по FSHR p.N680S [105]. Однако положительный эффект ФСГ не был обнаружен после трехмесячной терапии, а скорее после трехмесячного перерыва в лечении, что позволяет предположить, что нынешняя трехмесячная схема, вероятно, слишком коротка для получения устойчивого эффекта [105]. Точно так же апостериорный анализ другого клинического исследования подтвердил, что фармакогеномность ФСГБ может быть полезна для прогнозирования эффективности ФСГ при идиопатическом мужском бесплодии [130, 148].Таким образом, несколько правильно спланированных клинических испытаний имеют противоположные результаты, а результаты, полученные с помощью метаанализов, не преодолевают неоднородность этих исследований, не позволяя делать выводы, полезные для клинической практики. Недавнее общенациональное исследование в Италии оценило лечение идиопатического мужского бесплодия, выявив, что уровень назначения ФСГ составляет 55% [5]. Хотя это исследование не было разработано для определения эффективности ФСГ при мужском бесплодии, оно показало небольшое увеличение параметров спермы примерно у половины мужчин, прошедших лечение, что подтверждает необходимость проведения надлежащим образом спланированных более крупных клинических испытаний в этих условиях [5,52].Еще одна интересная область исследования - это роль лечения ФСГ / гонадотропином в случаях необструктивной азооспермии, при которой происходит извлечение сперматозоидов с помощью экстракции сперматозоидов из яичек (TESE) и микро-TESE. Подавляющее большинство наблюдательных исследований и обзоров предполагают, что повышенные уровни ФСГ в сыворотке крови следует рассматривать как отрицательные прогностические маркеры получения сперматозоидов после TESE / micro-TESE. Учитывая (предполагаемую) первичную неспособность яичек производить сперму в таких случаях, нет четких оснований предлагать дальнейшую стимуляцию ФСГ в присутствии уровней ФСГ в сыворотке выше нормального диапазона.Однако в некоторых исследованиях сообщалось об увеличении количества сперматозоидов, извлекаемых после TESE / micro-TESE у мужчин с необструктивной азооспермией, получавших цитрат кломифена [149], hCG [150], hMG [149] и FSH [151, 152]. Эти данные позволяют предположить, что минимальная остаточная сперматогенная активность может быть стимулирована даже в случае повышенных уровней ФСГ в сыворотке, по крайней мере, у некоторых пациентов. Однако роль введения ФСГ у мужчин с необструктивной азооспермией, подвергающихся хирургическим процедурам, не подтверждается достаточными доказательствами и остается экспериментальной.6. Перспективы на будущее
При перспективах клинического использования гонадотропинов у мужчин следует учитывать проблемы, все еще существующие при лечении как ГГ, так и идиопатического бесплодия. Что касается назначения гонадотропинов мужчинам с ДГ, некоторые вопросы остаются нерешенными. Во-первых, многие исследования показали, что одного ХГЧ достаточно для восстановления сперматогенеза, а добавление ФСГ может только увеличить количество сперматозоидов [1,153]. Таким образом, тестостерон внутри яичек, по-видимому, способен только стимулировать сперматогенез, подавляя действие ФСГ на клетки Сертоли.Более того, нет четких доказательств того, в какое время следует добавлять ФСГ к стимуляции ХГЧ или какая доза ФСГ требуется. Таким образом, конкретные испытания, направленные на анализ наилучшего терапевтического подхода к мужчинам с ДГ, все еще остаются незавершенными, фокусируясь на необходимости, дозе и времени добавления ФСГ к ХГЧ. Следует отметить, что все доступные результаты по этой теме использовали ХГЧ для стимуляции выработки тестостерона внутри яичек, а не физиологического гормона ЛГ. Хотя ЛГ и ХГЧ действуют на один и тот же рецептор, недавние исследования продемонстрировали разные пути передачи сигнала на клеточном уровне и разные клинические исходы in vivo, по крайней мере, у женщин, подвергающихся вспомогательной репродукции [2,154].Причина использования ХГЧ вместо ЛГ больше связана с историческими и практическими причинами (доступность, период полураспада и стоимость), чем с научными данными. Действительно, первое выделение гонадотропина датируется 1930-1950-ми годами, и полученный препарат, называемый менопаузальным гонадотропином человека (чМГ), представлял собой смесь 50/50 ФСГ и ЛГ. Усовершенствования методики получения чистых гормонов привели к эффективному производству высокоочищенного ФСГ из мочи женщин в постменопаузе, но ЛГ теряется при хроматографической процедуре.Следовательно, есть необходимость добавлять ХГЧ (из мочи беременных) к современным препаратам ЧМГ. Принимая во внимание активность и период полувыведения ХГЧ, не было предпринято попыток получить гипофизарный ЛГ из мочи с уверенностью, что два гонадотропина обладают одинаковым биологическим действием [2]. Теперь, когда доступны рекомбинантные гонадотропины, следует рассмотреть новые данные о различиях между действием ЛГ и ХГЧ, которые могут открыть дальнейшие перспективы потенциальной терапевтической роли ЛГ в стимуляции функции яичек.Введение гонадотропина мужчинам с HH приводит к увеличению концентрации сперматозоидов до среднего значения 5,92 миллиона на мл до наступления беременности, после чего этот режим прекращают [1]. Хотя этого увеличения недостаточно для достижения нормозооспермического диапазона по данным Всемирной организации здравоохранения (ВОЗ) (т.е.> 15 миллионов на мл) [155], оно в значительной степени совместимо с фертильностью у этих мужчин [156, 157, 158, 159, 160, 161]. Таким образом, причина, по которой фармакологическая стимуляция гонадотропинами не восстанавливает полностью сперматогенез у таких пациентов даже после многих месяцев, а иногда и лет (недостаточная продолжительность? Неоптимальные протоколы стимуляции? ХГЧ vs.LH?), Является неясным, интригующим и еще предстоит полностью открыть. Точно так же в будущих перспективах в этой области следует учитывать, какой график стимуляции гонадотропинами является наилучшим. Действительно, как ФСГ, так и ЛГ физиологически секретируются гипофизом пульсирующим образом, и этот секреторный ритм считается важным для фертильности у всех млекопитающих, включая человека [162]. Остается неясным, является ли текущий непульсирующий режим введения экзогенных гонадотропинов наиболее эффективным для стимуляции семенников человека в клинической практике.Еще один важный вопрос, который необходимо разработать, - как лечить мальчиков HH до полового созревания, поскольку в настоящее время они диагностируются очень рано. Действительно, стандартным лечением подростков мужского пола с ДГ остается введение тестостерона, чтобы вызвать вирилизацию и психосексуальное созревание [163]. Однако заместительная терапия тестостероном не вызывает сперматогенеза, что, наоборот, требует введения гонадотропинов [164]. В настоящее время неясно, следует ли проводить индукцию полового созревания сначала тестостероном, а затем гонадотропинами или наоборот [165].Недавно Zacharin et al. описали полное пубертатное развитие у 19 мальчиков HH, получавших как ХГЧ, так и ФСГ, с обретением фертильности и заметным улучшением качества жизни, независимо от предыдущей замены тестостерона [166]. Таким образом, кажется, что введение гонадотропина необходимо для стимуляции развития яичек HH, и это может быть выполнено как до, так и после введения тестостерона. Однако вопрос о том, в какое время нужно начинать стимуляцию гонадотропинами, чтобы вызвать половое созревание, остается спорным и требует правильно спланированных испытаний.В условиях мужского идиопатического бесплодия необходимы дальнейшие фармакогеномические исследования для проспективной оценки того, как отбирать пациентов для лечения и адаптировать введение ФСГ. Для этой цели может быть полезна фармакогеномическая оценка роли FSHR и FSHB SNP в мужской фертильности. Действительно, поскольку генетические гаплотипы связаны со сниженной физиологической стимуляцией ФСГ на сперматогенез, этим пациентам могут быть полезны более высокие дозы ФСГ или более длительная продолжительность лечения. С другой стороны, наиболее благоприятные генетические гаплотипы могут быть в достаточной степени стимулированы текущими эмпирическими схемами лечения ФСГ.Таким образом, необходимы новые комплексные подходы, связывающие генетический фон со сперматогенезом и ответом на лечение [52]. Наконец, новые перспективы связаны с применением новых соединений с активностью гонадотропина. Например, корифоллитропин альфа представляет собой рекомбинантный гормон, полученный путем комбинирования α-субъединицы гонадотропина с химерной субъединицей FSHβ, слитой с карбоксиконцевым пептидом (CTP) субъединицы hCGβ. Это соединение имеет более длительный период полужизни, чем ФСГ, из-за дополнительных сайтов гликозилирования в CTP-части [167].Поскольку у женщин, получающих АРТ, корифоллитропин альфа вызывает терапевтический ответ, аналогичный препаратам рекомбинантного ФСГ [168], утверждается, что одна инъекция корифоллитропина альфа может заменить семь ежедневных введений ФСГ. В отношении мужчин, поскольку схемы лечения гонадотропином обычно предполагают длительное лечение с частыми инъекциями, использование корифоллитропина альфа может привести к меньшему количеству ошибок при приеме лекарств и улучшению соблюдения режима [169]. Заместительная терапия корифоллитропином альфа была оценена у мужчин с HH, продемонстрировав эффективность и безопасность, аналогичную эффективности и безопасности ФСГ [169].С другой стороны, это новое соединение никогда не тестировалось в контексте мужского идиопатического бесплодия. Таким образом, необходимо провести дальнейшие исследования возможности применения корифоллитропина альфа при идиопатическом мужском бесплодии. Были предприняты дальнейшие попытки разработать гонадотропины длительного действия. Усилия, предпринятые в этом направлении, включали присоединение полиэтиленгликоля (ПЭГ) для увеличения периода полужизни, биодоступности и биологической активности. Ковалентное добавление ПЭГ приводит к повышенной растворимости и увеличению размера, следовательно, к снижению почечного клиренса и защите от протеолитической деградации.ФСГ, конъюгированный с ПЭГ, сохранял активность ФСГ in vitro на кумулюсных клетках крупного рогатого скота [170]. Интересно, что пегилированный ФСГ показал улучшенную биодоступность по сравнению с ФСГ у крыс [171]. Другая стратегия продления периода полужизни гормона заключается в разработке препаратов с замедленным высвобождением с использованием гелевой суспензии гидроксида алюминия. Этот подход привел к продлению биологической активности у кроликов и крупного рогатого скота [172, 173]. Также сообщалось о одноцепочечных гонадотропинах с улучшенной фармакокинетикой (см. [174] для недавнего обзора).Пионерское исследование [175] продемонстрировало, что одноцепочечный рекомбинантный аналог, в котором субъединица hCGβ слита с N-концом α-субъединицы гонадотропина, демонстрирует улучшенную биопотентность in vivo по сравнению с гетеродимерным hCG. Этот первоначальный успех привел к разработке одноцепочечных аналогов ЛГ и ФСГ. Они были сконструированы с β-субъединицами, ориентированными на N-конце субъединицы α, и использовали последовательность hCGβ CTP в качестве линкера, что привело к увеличению периода полужизни in vivo. Интересно, что у них была аналогичная или даже более высокая секреция in vitro и биологическая активность in vivo, чем у их нативных гормональных аналогов [176, 177, 178].Например, было продемонстрировано, что однократная инъекция одноцепочечного аналога ФСГ может стимулировать выработку эстрогена в течение 5-7 дней у макак-резусов [179]. Как и ожидалось, O-связанные сайты гликозилирования карбоксиконцевого пептида (CTP) снижали скорость печеночного клиренса, способствуя увеличению периода полужизни в сыворотке и повышению биопотентности одноцепочечных аналогов. Позже были разработаны некоторые аналоги с двойной активностью ФСГ и ЛГ. Такие аналоги с двойной активностью могут быть актуальны для лечения ДГ и бесплодных мужчин.Эти конструкции включали FSHβ-CTP-CGβ-α и FSHβ-CTP-LHβ-CTP-α, и при введении овцам вызывали повышенную концентрацию эстрадиола в сыворотке, массу яичников и образование желтых тел [177, 180, 181]. Скорость клиренса двойного активного FSHβ-CTP-LHβ-CTP-α также была значительно улучшена по сравнению с эндогенным гонадотропином овцы (от 1 до 2 часов). Несмотря на эти многообещающие показания, на сегодняшний день ни один одноцепочечный или двухактивный аналог гонадотропина не достиг клинической фазы разработки. Недавно был сконструирован гибридный белок, состоящий из FSHα и β-субъединиц, слитых с Fc-фрагментами иммуноглобулина. от выгодных фармакокинетических свойств иммуноглобулинов [182,183].Самки крыс, которым вводили этот аналог ФСГ-Fc, демонстрировали значительно увеличенный вес яичников по сравнению с животными, получавшими ФСГ. При совершенно ином подходе низкомолекулярные (НМ) химические вещества, оказывающие агонистическое действие на ФСГ, также представляют собой интригующую альтернативу для лечения мужчин в HH и бесплодие. Хотя такие соединения не обладают относительно длительным периодом полужизни in vivo, они могут быть разработаны для перорального введения. Другим преимуществом является относительно ограниченная стоимость этого типа молекул по сравнению с биологическими препаратами, такими как рекомбинантные гонадотропины.Следовательно, можно было бы предусмотреть долгосрочное лечение с высокой дозировкой без ущерба для соблюдения пациентом или финансовой устойчивости системы здравоохранения. Хотя разработка агонистов LMW к рецепторам гонадотропина была очень сложной задачей по сравнению с некоторыми другими GPCR, это, вероятно, связано со специфической природой взаимодействия FSH с внеклеточным доменом FSHR и последующей цепочкой молекулярных событий, которые приводят к передаче сигнала. На протяжении многих лет сообщалось о различных модуляторах LMW, действующих на FSHR.Среди них ряд тиазолидинонов (TDZ) был идентифицирован комбинаторным скринингом [184]. Некоторые производные TDZ проявляют агонистическую / положительную аллостерическую модуляцию (PAM) в FSHR [185]. Действительно, некоторые ТДЗ способны стимулировать ФСГ-индуцированную передачу сигналов в отсутствие ФСГ и способны индуцировать фолликулогенез у неполовозрелых крыс. Несмотря на столь многообещающие результаты, эти соединения так и не поступили на рынок из-за неблагоприятных фармакокинетических параметров [186]. Другие соединения из серии TDZ показали способность переключать связывание FSHR с Gα s на Gα i без выяснения функциональных последствий для воспроизводства на сегодняшний день [187].Другой класс LMW-лигандов, способных связываться с FSHR, - это бензамидный ряд. Эти соединения проявляют селективность к FSHR по сравнению с TSHR и LHCGR. В присутствии физиологической концентрации ФСГ (ЕС 20 ) некоторые производные бензамида усиливали опосредованную ФСГ активность рецептора, ведя себя как ПАМ [188]. Аналогичным образом, дигидропиридиновое соединение Org 24444-0, как сообщалось, также увеличивает вызванное ФСГ производство цАМФ in vitro посредством механизма действия PAM. Интересно, что Org 24444-0 воспроизводит эффекты FSH на созревание фолликулов in vivo [189].Другие LMW-лиганды также были идентифицированы из-за их способности отключать передачу сигналов FSHR. Среди них тетрагидрохинолины показали сильные ингибирующие эффекты на продукцию цАМФ без нарушения связывания ФСГ. К сожалению, in vivo эффекта не наблюдалось [190]. Совсем недавно в серию ADX были включены отрицательные аллостерические модуляторы (NAM), действующие на FSHR. В частности, ADX61623 демонстрирует пониженную продукцию цАМФ, индуцированную ФСГР, и улучшенную аффинность связывания ФСГ. Более того, при применении к первичным клеткам гранулезы ADX61623 снижает выработку прогестерона, но не эстрадиола [191].Два других соединения из серии ADX позже были описаны как смещенные NAM на FSHR: ADX68692 и ADX68693. ADX68692 снижает продукцию цАМФ, прогестерона и эстрадиола in vitro в клетках гранулезы крыс. Однако ADX68693 демонстрирует аналогичное ингибирующее действие на прогестерон, хотя он не снижает выработку эстрадиола в той же модельной системе. Интересно, что in vivo ADX68692 эффективно снижает количество ооцитов, выделяемых у зрелых самок крыс, тогда как ADX68693 - нет [192]. Однако важно отметить, что эти два соединения также влияют на передачу сигналов LHCGR, подчеркивая неразборчивость между рецепторами гонадотропина для этого ряда ADX [193].Несмотря на эти многообещающие разработки, ни одно из низкомолекулярных соединений до сих пор не достигло клинических стадий. Дальнейшие разработки потребуются для разработки орально активного агониста LMW FSHR.Несмотря на то, что ни одна из этих различных стратегий улучшения биологической активности / биодоступности / введения еще не была протестирована клинически, они открывают многообещающие возможности для исследований для разработки терапевтических препаратов с гонадотропинами, которые лучше подходят для лечения мужчин с ДГ и бесплодия.