HTML/Элемент br
Синтаксис
HTML
XHTML
Описание
Элемент br (от англ. «break» ‒ «ломать, разрывать») осуществляет перевод строки. Данный элемент часто используется при написании стихов, так как в отличии от элемента абзаца элемент перевода строки не создает отступа (если таковой задан) в новой строке.
Поддержка браузерами
Chrome
Поддерж.
Firefox
Поддерж.
Opera
Поддерж.
Maxthon
Поддерж.
IExplorer
Поддерж.
Safari
Поддерж.
iOS
Поддерж.
Android
Поддерж.
Спецификация
| Верс. | Раздел | |
|---|---|---|
| HTML | ||
| 2.0 | Line Break: BR | Перевод |
3. 2 2 | ||
| 4.01 | 9.3.2 Controlling line breaks Forcing a line break: the BR element… DTD: Transitional
Strict
Frameset | |
| 5.0 | 4.5.29 The br element | |
| 5.1 | 4.5.29. The br element | |
| XHTML | ||
| 1.0 | Extensible HyperText Markup Language DTD: Transitional
Strict
Frameset | |
| 1.1 | Extensible HyperText Markup Language | |
Атрибуты
- clear
- Работа со следующей строкой (обтекание), при наличии плавающего объекта.

- Глобальные атрибуты
- accesskey, class, contenteditable, contextmenu, data-*, dir, draggable, dropzone, hidden, id, inert, lang, spellcheck, style, tabindex, title, translate, xml:lang
Пример использования
Листинг кода
<!DOCTYPE html>
<html>
<head>
<meta charset=»utf-8″>
<title>Элемент br</title>
</head>
<body>
<h2>Пример с элементом «br»</h2>
<article>
<h3>Стих</h3>
<p>
Умом Россию не понять,<br>
Аршином общим не измерить:<br>
У ней особенная стать —<br>
В Россию можно только верить.<br>
</p>
<address><b>Ф. И. Тютчев</b></address>
</body>
</html>
Элемент br
| HTML | WebReference
- Содержание
- Синтаксис
- Закрывающий тег
- Атрибуты
- Пример
- Спецификация
- Браузеры
Элемент <br> (от англ.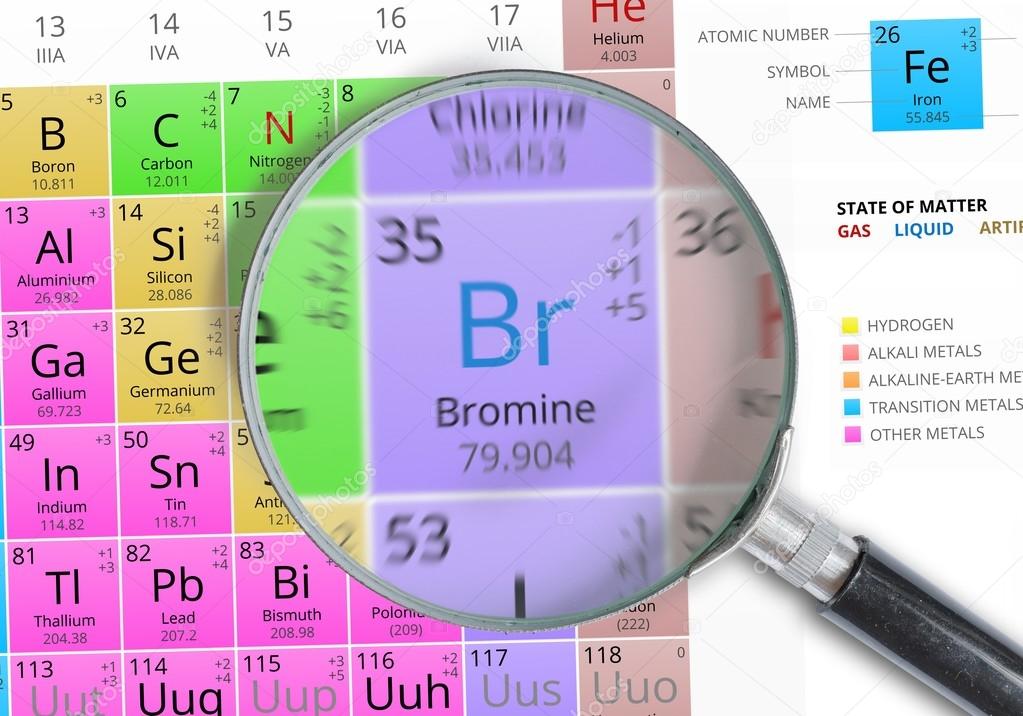 line break — перенос строки) устанавливает перевод строки в том месте, где он находится. В отличие от элемента <p>, использование <br> не добавляет пустой отступ перед строкой.
line break — перенос строки) устанавливает перевод строки в том месте, где он находится. В отличие от элемента <p>, использование <br> не добавляет пустой отступ перед строкой.
Синтаксис
Текст<br> текст
Закрывающий тег
Не требуется.
Атрибуты
- clear
- Сообщает браузеру, как обрабатывать следующую строку, если текст обтекает элемент.
Пример
<!DOCTYPE HTML> <html> <head> <meta charset=»utf-8″> <title>BR</title> </head> <body> <p>Р.Л. Стивенсон</p> <p>Лето в стране настало,<br> Вереск опять цветёт.<br> Но некому готовить<br> Вересковый мёд.</p> </body> </html> Результат данного примера показан на рис. 1.Рис. 1. Вид текста при использовании <br>
Спецификация
| Спецификация | Статус |
|---|---|
| WHATWG HTML Living Standard | Живой стандарт |
| HTML5 | Рекомендация |
HTML 4. 01 Specification 01 Specification | Рекомендация |
Спецификация
Каждая спецификация проходит несколько стадий одобрения.
- Recommendation (Рекомендация) — спецификация одобрена W3C и рекомендована как стандарт.
- Candidate Recommendation (Возможная рекомендация) — группа, отвечающая за стандарт, удовлетворена, как он соответствует своим целям, но требуется помощь сообщества разработчиков по реализации стандарта.
- Proposed Recommendation (Предлагаемая рекомендация) — на этом этапе документ представлен на рассмотрение Консультативного совета W3C для окончательного утверждения.
- Working Draft (Рабочий проект) — более зрелая версия черновика после обсуждения и внесения поправок для рассмотрения сообществом.
- Editor’s draft (Редакторский черновик) — черновая версия стандарта после внесения правок редакторами проекта.
- Draft (Черновик спецификации) — первая черновая версия стандарта.
Особняком стоит живой стандарт HTML (Living) — он не придерживается традиционной нумерации версий, поскольку находится в постоянной разработке и обновляется регулярно.
Браузеры
| 3 | 12 | 1 | 3.5 | 1 | 1 |
| 1 | 1 | 6 | 1 |
Браузеры
В таблице браузеров применяются следующие обозначения.
- — элемент полностью поддерживается браузером;
- — элемент браузером не воспринимается и игнорируется;
- — при работе возможно появление различных ошибок, либо элемент поддерживается с оговорками.
Число указывает версию браузреа, начиная с которой элемент поддерживается.
См. также
- Форматирование HTML
Практика
- Важный текст
- Переносы строк
Автор и редакторы
Автор: Влад Мержевич
Последнее изменение: 09. 10.2018
10.2018
Редакторы: Влад Мержевич
HTML тег br
❮ Назад Полный справочник HTML Далее ❯
Пример
Вставка одиночных разрывов строк в тексте:
Чтобы принудительно
разрывы строк
в тексте,
используйте элемент br
.
Попробуйте сами »
Другие примеры «Попробуйте сами» ниже.
Определение и использование
Тег вставляет одиночный разрыв строки.
9Тег 0020 полезен для написания адресов или стихов.
Тег является пустым тегом, что означает, что он не имеет конечного тега.
Советы и примечания
Примечание: Используйте тег для ввода разрывов строк, а не для
добавить пробел между абзацами.
Поддержка браузера
| Элемент | |||||
|---|---|---|---|---|---|
| | Да | Да | Да | Да | Да |
Глобальные атрибуты
Тег также поддерживает глобальные атрибуты в HTML.

Атрибуты событий
Тег также поддерживает атрибуты событий в HTML.
Другие примеры
Пример
Используйте
в стихотворении:
Не бойся величия.
Некоторые рождаются великими,
некоторые
достичь величия,
и другим навязано величие.
-Уильям Шекспир
Попробуйте сами »
Связанные страницы
Руководство по HTML: параграфы HTML
Ссылка HTML DOM: объект BR
Настройки CSS по умолчанию
Нет.
❮ Предыдущий Полный справочник HTML Следующая ❯
НОВИНКА
Мы только что запустили
Видео W3Schools
Узнать
ВЫБОР ЦВЕТА
КОД ИГРЫ
Играть в игру
Лучшие учебники
Учебное пособие по HTMLУчебное пособие по CSS
Учебное пособие по JavaScript
Учебное пособие
Учебное пособие по SQL
Учебное пособие по Python
Учебное пособие по W3.
 CSS
CSS Учебное пособие по Bootstrap
Учебное пособие по PHP
Учебное пособие по Java
Учебное пособие по C++
Учебное пособие по jQuery
20 Справочник по HTML
Справочник по CSS
Справочник по JavaScript
Справочник по SQL
Справочник по Python
Справочник по W3.CSS
Справочник по Bootstrap
Справочник по PHP
Справочник по Java
Справочник по Angular
Справочник по jQuery
2 Top0 Examples Примеры HTML
Примеры CSS
Примеры JavaScript
Примеры инструкций
Примеры SQL
Примеры Python
Примеры W3.CSS
Примеры Bootstrap
Примеры PHP
Примеры Java
Примеры XML
Примеры jQuery
FORUM | О
W3Schools оптимизирован для обучения и обучения. Примеры могут быть упрощены для улучшения чтения и обучения.
Учебники, ссылки и примеры постоянно пересматриваются, чтобы избежать ошибок, но мы не можем гарантировать полную правильность всего содержания. Используя W3Schools, вы соглашаетесь прочитать и принять наши условия использования,
куки-файлы и политика конфиденциальности.
Используя W3Schools, вы соглашаетесь прочитать и принять наши условия использования,
куки-файлы и политика конфиденциальности.
Copyright 1999-2022 Refsnes Data. Все права защищены.
бром | Свойства, использование и факты
бром
Посмотреть все СМИ
- Ключевые люди:
- Антуан-Жером Балар Виктор Мейер
- Похожие темы:
- химический элемент галоген
Просмотреть весь связанный контент →
Резюме
Прочтите краткий обзор этой темы
бром (Br) , химический элемент, темно-красная ядовитая жидкость, член группы галогенов или группы 17 (группа VIIa) периодической таблицы.
| atomic number | 35 |
|---|---|
| atomic weight | [79.901, 79.907] |
| melting point | −7. 2 °C (19 °F) 2 °C (19 °F) |
| boiling точка | 59 °C (138 °F) |
| удельный вес | 3.12 при 20 °C (68 °F) |
| степени окисления | −1, +1, +3, +5, +7 |
| электронная конфигурация | 3 (Ar) D 10 4 S 2 4 P 5
ИСТОРИЯ
БРМИН БЛОКОВОЙ БЛИНАРИНА (БИЛИНЕР ИСПОЛЬЗОВАНИЕ В СЛОВОЙ ЖИЗНЕ В ЛИЧЕСЕ ИСПОЛНЕНИЕ В СЛОВОЙ ЖИЗНЕ ИЗНЕЛИНЕ В СИЛИНЕ В СЛОВОЙ ЖИЗНЕ В СЛОВОЙ ЖИЗНЕ ИЗНЕЛИНЕ В СЛОВОЙ ЖИЗНЕ ИЗНЕЛИНЕ. морской соли в Монпелье. Он освободил элемент, пропуская хлор через водный раствор остатков, который содержал бромид магния. Перегонка материала с диоксидом марганца и серной кислотой дала красные пары, которые конденсировались в темную жидкость. Сходство этой процедуры с процедурой получения хлора навело Балара на мысль, что он получил новый элемент, подобный хлору. (Немецкий химик Юстус фон Либих, по-видимому, получил этот элемент раньше Балара, но он ошибочно полагал, что это хлорид йода.) Из-за неприятного запаха этого элемента Французская академия наук предложила название бром, от греческого слова bromos , что означает «неприятный запах» или «вонь».
(Немецкий химик Юстус фон Либих, по-видимому, получил этот элемент раньше Балара, но он ошибочно полагал, что это хлорид йода.) Из-за неприятного запаха этого элемента Французская академия наук предложила название бром, от греческого слова bromos , что означает «неприятный запах» или «вонь».
Наличие и распространение
Бром, редкий элемент, встречается в природе рассеянным по всей земной коре только в виде соединений в виде растворимых и нерастворимых бромидов. Некоторое обогащение происходит в океанской воде (65 частей на миллион по весу), в Мертвом море (приблизительно 5 граммов на литр [0,7 унции на галлон]), в некоторых термальных источниках и в редких нерастворимых минералах бромида серебра (таких как бромирит, встречается в Мексике и Чили). Природные месторождения солей и рассолы являются основными источниками брома и его соединений. Иордания, Израиль, Китай и Соединенные Штаты лидировали в мире по производству брома в начале 21 века; другие важные страны-производители брома в этот период включают Японию, Украину и Индию.
Бром природный представляет собой смесь двух стабильных изотопов: брома-79 (50,54%) и брома-81 (49,46%). Из 17 известных радиоактивных изотопов элемента бром-77 имеет самый длительный период полураспада (57 часов).
Britannica Викторина
118 Названия и символы периодической таблицы Викторина
Элементарная викторина по фундаментальным вопросам.
Физические и химические свойства
Свободный бром представляет собой красновато-коричневую жидкость с заметным давлением паров при комнатной температуре. Пары брома имеют янтарный цвет. Бром имеет резкий запах и раздражает кожу, глаза и дыхательную систему. Воздействие паров концентрированного брома даже на короткое время может привести к летальному исходу. Как и другие галогены, бром существует в виде двухатомных молекул во всех агрегатных состояниях.
Около 3,41 грамма (0,12 унции) брома растворяется в 100 мл (0,1 кварты) воды при комнатной температуре. Раствор известен как бромная вода. Подобно хлорной воде, это хороший окислитель, и он более полезен, потому что не так легко разлагается. Он высвобождает свободный йод из йодидсодержащих растворов и серу из сероводорода. Сернистая кислота окисляется бромной водой до серной кислоты. На солнечном свету бромная вода разлагается с выделением кислорода, как в следующем уравнении:
Подобно хлорной воде, это хороший окислитель, и он более полезен, потому что не так легко разлагается. Он высвобождает свободный йод из йодидсодержащих растворов и серу из сероводорода. Сернистая кислота окисляется бромной водой до серной кислоты. На солнечном свету бромная вода разлагается с выделением кислорода, как в следующем уравнении:
Оформите подписку Britannica Premium и получите доступ к эксклюзивному контенту. Подписаться
Из бромной воды можно выделить гидрат (клатрат), который содержит 172 молекулы воды и 20 полостей, способных вместить молекулы брома. Бром растворяется в водных растворах гидроксидов щелочных металлов, давая бромиды, гипобромиты или броматы, в зависимости от температуры. Бром легко извлекается из воды органическими растворителями, такими как четыреххлористый углерод, хлороформ или сероуглерод, в которых он хорошо растворим. В органических растворителях дает оранжевый раствор.
Сродство к электрону брома высокое и такое же, как у хлора.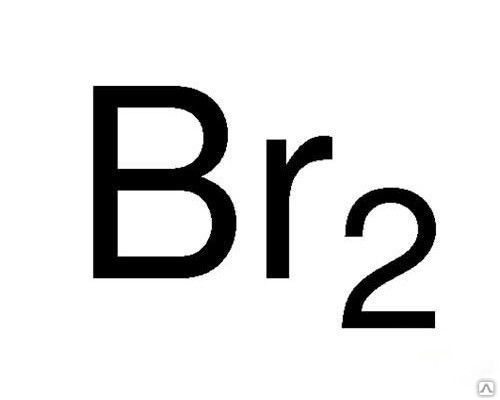 Однако он является менее сильным окислителем, главным образом из-за более слабой гидратации бромид-иона по сравнению с хлорид-ионом. Точно так же связь металл-бром слабее, чем соответствующая связь металл-хлор, и это различие отражается в химической активности брома, которая находится между реакционной способностью хлора и йода. Органическое соединение брома похоже на соответствующее производное хлора, но обычно более плотное, менее летучее, менее горючее и менее стабильное.
Однако он является менее сильным окислителем, главным образом из-за более слабой гидратации бромид-иона по сравнению с хлорид-ионом. Точно так же связь металл-бром слабее, чем соответствующая связь металл-хлор, и это различие отражается в химической активности брома, которая находится между реакционной способностью хлора и йода. Органическое соединение брома похоже на соответствующее производное хлора, но обычно более плотное, менее летучее, менее горючее и менее стабильное.
Бром бурно соединяется с щелочными металлами, а также с фосфором, мышьяком, алюминием и сурьмой, но менее бурно с некоторыми другими металлами. Бром вытесняет водород из насыщенных углеводородов и присоединяется к ненасыщенным углеводородам, хотя и не так быстро, как это делает хлор.
Наиболее стабильной степенью окисления элемента является -1, при которой бром встречается в природе. Но степени окисления 0 (элементарный бром, Br 2 ), +1 (гипобромит, BrO - ), +3 (бромит, BrO - 2 ), +5 (бромат, BrO - 3 ) и +7 (пербромат, BrO - 4 ) также известны. Первая энергия ионизации брома высока, и соединения, содержащие бром в положительных степенях окисления, стабилизируются соответствующими лигандами, главным образом кислородом и фтором. Соединения со степенью окисления +1, +3, +4, +5 и +7 содержат ковалентные связи.
Первая энергия ионизации брома высока, и соединения, содержащие бром в положительных степенях окисления, стабилизируются соответствующими лигандами, главным образом кислородом и фтором. Соединения со степенью окисления +1, +3, +4, +5 и +7 содержат ковалентные связи.
Производство и использование
Основным коммерческим источником брома является морская вода, из которой элемент извлекают путем химического замещения (окисления) хлором в присутствии серной кислоты по реакции
Продукт реакции – разбавленный раствор брома, из которого элемент удаляют продуванием воздуха. Затем свободный бром смешивают с двуокисью серы, и смешанные газы пропускают вверх по башне, по которой стекает вода. В градирне происходит следующая реакция:
, в результате чего получается смесь кислот, которая намного богаче ионами брома, чем морская вода. Вторая обработка хлором высвобождает бром, который освобождается от хлора и очищается путем пропускания через влажные железные опилки.
Товарный бром обычно содержит до 0,3 процента хлора. Обычно его хранят в стеклянных бутылках или в бочках, покрытых свинцовым или монель-металлическим покрытием.
В промышленном использовании брома преобладало соединение бромистого этилена (C 2 H 4 Br 2 ), которое когда-то добавляли в бензин с тетраэтилсвинцом для предотвращения отложения свинца в двигателе. После отказа от этилированного бензина соединения брома в основном использовались в антипиренах, но бромистый этилен по-прежнему остается важным соединением, поскольку он используется для уничтожения нематод и других вредителей в почве. Бром также используется в производстве катализаторов, таких как бромид алюминия.
Бром используется и в других целях, например, в производстве различных красителей и соединений тетрабромэтана (C 2 H 2 Br 4 ) и бромоформа (CHBr 3 ), которые используются в качестве жидкостей в манометрах из-за их высокой удельный вес.