Типовые конфигурации фирмы «1С», поддерживающие технологию DirectBank
1С:Предприятие 8
Система программ
- Главная
- Обмен данными и интеграция
- Реализованные решения
- DirectBank (прямой обмен с банком)
- Типовые конфигурации фирмы «1С», поддерживающие технологию DirectBank
В силу специфики работы самого прикладного решения (его функционального назначения для решения задач автоматизации и учета) в нем могут быть реализованы не все документы стандарта DirectBank.
- «1С:Бухгалтерия 8», редакция 3.0 — Инструкция по настройке DirectBank на 1С:ИТС
- «1С:ERP Управление предприятием 2» — Инструкция по настройке DirectBank на 1С:ИТС
- «1С:ERP. Управление холдингом»
- «1С:Комплексная автоматизация», редакция 2.0 — Инструкция по настройке DirectBank на 1С:ИТС
- «1С:Управление холдингом 8» — Инструкция по настройке DirectBank на 1С:ИТС
- «1С:Управление торговлей 8», редакция 11 — Инструкция по настройке DirectBank на 1С:ИТС
- «1С:Зарплата и управление персоналом 8», редакция 3 — Инструкция по настройке DirectBank на 1С:ИТС
- «1С:Зарплата и кадры государственного учреждения 8», редакция 3 — Инструкция по настройке DirectBank на 1С:ИТС
- «1С:Управление нашей фирмой» — Инструкция по настройке DirectBank на 1С:ИТС
- «1С:Предприниматель» — Инструкция по настройке DirectBank на 1С:ИТС
- «1С:Розница» — Инструкция по настройке DirectBank на 1С:ИТС
- Конфигурации, разработанные на основе «1С:Бухаглтерия» (Бухгалтерия НКО, Садовод, Гаражи и другие — уточняйте при покупке или на ЛК поставщика).

Функциональность прямого обмена с банком из системы «1С:Предприятие 8» по технологии DirectBank входит в состав конфигурации «1С:Библиотека электронных документов», распространяемой фирмой «1С» на ресурсах информационно-технологического сопровождения (ИТС) и легко может быть включен партнерами 1С в свои конфигурации (см. Информация для пользователей и партнеров № 15 245 от 18.06.2012.)
Правила и форматы обмена опубликованы в разделе Стандарт взаимодействия между «1С:Предприятие 8» и Банком по технологии DirectBank.
Описание сервисов «1С:Предприятие 8» через Интернет смотрите на 1cfresh.com.
Функциональность прикладных решений
Конфигурации 1С. Их виды и назначения
Для тех, кто задумывается о том, чтобы внедрить на своем предприятии работу с учетной системой 1С для начала требуется определить круг задач, которые он желает решить, а затем выбрать подходящую типовую , максимально отвечающая его требованиям. Или несколько программных продуктов. Однако для совершения осознанного и объективного выбора следует узнать, что такое типовые конфигурации 1С, какие они могут быть, какие задачи решают?
Или несколько программных продуктов. Однако для совершения осознанного и объективного выбора следует узнать, что такое типовые конфигурации 1С, какие они могут быть, какие задачи решают?
Типовые конфигурации – программные продукты для построения учета, которые разрабатывает фирма 1С. Существует довольно широкий выбор разнообразных продуктов от компании 1С. Однако типовых программ от 1С, которые чаще всего востребованы, довольно мало – меньше одного десятка. Помимо разделения по набору функциональных возможностей, конфигурации 1С бывают нескольких уровней:
- Базовая
- Профессиональная
- Корпоративная
Типовые конфигурации 1С
Итак, ниже мы приведем ряд таких конфигураций, максимально востребованых среди пользователей среди всех учетных систем 1С и подходят для построения автоматизации бизнес процессов на большинстве российских компании
1С Бухгалтерия
Это, пожалуй, самая известная система 1С из всех возможных. Кроме того, потребность в данной конфигурации есть на любом предприятии вне зависимости от размаха бизнеса и специфики его работы, так как бухгалтерский учет требуется вести в любой ситуации. Этот продукт 1С дает возможность построить бухгалтерский учет согласно актуальной версии Российского законодательства. Кроме того, оперативные обновления системы позволяют держать функциональность системы в соответствии со всеми требованиями закона касательно ведения бухгалтерского и налогового учета.
Кроме того, потребность в данной конфигурации есть на любом предприятии вне зависимости от размаха бизнеса и специфики его работы, так как бухгалтерский учет требуется вести в любой ситуации. Этот продукт 1С дает возможность построить бухгалтерский учет согласно актуальной версии Российского законодательства. Кроме того, оперативные обновления системы позволяют держать функциональность системы в соответствии со всеми требованиями закона касательно ведения бухгалтерского и налогового учета.
1С Зарплата и управление персоналом
Данная конфигурация обладает несколькими, весьма внушительных по своей емкости блоков. Система позволяет вести:
- полный расчет заработной платы;
- Начисление всех положенных налогов и отчислений
- ведение кадрового учета согласно актуальным нормам законодательства.

Система содержит не просто возможность вести необходимые согласно закону кадровые документы, формировать отчеты для гос органов, но и вести сложную калькуляцию заработной платы и всех положенных сотруднику выплат, с учетом отпусков, отгулов, прогулов, штрафов, премий, налогов, бонусов, авансов и прочего)
1С: Управление торговлей
Система используется задач автоматизации процессов оперативного и управленческого учета, процессов планирования торговли, анализа показателей бизнеса на уровне торговли и обеспечения. Оперативная отчетность радикально отличается от регламентированных отчетов, которые подаются в контролирующие органы. Главная функция оперативной отчетности – отражение реального отражения показателей на предприятии в настоящий момент.
1С: Розница
Данное программное решение является измененной версией программного продукта Управление торговлей. Главной функцией является автоматизация процессов ведения розничной торговли.
Эта конфигурация подойдет для абсолютно любого магазина вне зависимости от степени специфики
Система интегрируется как с другими системами 1С – Бухгалтерия, Управление Торговлей, так и с аппаратами, задействованными в сфере розничной торговли – кассы, фискальные регистраторы, сканер штрих-кодов и прочее.
1С: Документооборот
Вслед за динамикой роста любой компании, растет напряженность и интенсивность процессов документооборота, который протекает как внутри компании между подразделениями, и сотрудниками, так с внешними контрагентами. Усложняет внутренняя структура компании, возникает множество регламентов, которые стабилизируют работу компании, но одновременно усиливают напряженность и объем документооборота.
Типовая консигнация 1С Документооборот обладает функциональностью по автоматизации процедур прохождения любой документации – внутренний, входящей, исходящей. Создает, регистрирует и архивирует документы. Делает возможным сделать процессы прохождения документов прозрачными, прогнозируемыми, оперативно отслеживаемыми. Кроме того, позволяет отказаться от необходимости вести внутренний документооборот компании на бумажных носителях.
Делает возможным сделать процессы прохождения документов прозрачными, прогнозируемыми, оперативно отслеживаемыми. Кроме того, позволяет отказаться от необходимости вести внутренний документооборот компании на бумажных носителях.
Комплексные конфигурации 1С
Выше мы представили типовые программы 1С, которые автоматизируют либо определенные службы в компании, либо отдельные кластеры процессов.
Однако существет ряд типовых конфигураций, функционально содержащих инструменты для автоматизации совокупной деятельности фирмы – и их можно назвать комплексными.
1С Управление небольшой фирмой (УНФ)
Основной целью для этой конфигурации является построения комплексного учета в малых и средних компаниях производственной сферы (впрочем, многие торговые компании также делают выбор в пользу данного продукта). Система, однако не включает в себя функции ведения бух.учета и требует интеграции с продуктом 1С Бухгалтерия.
1С: Комплексная автоматизация (КА)
Система предназначена для предприятий среднего уровня, работающих как в сфере производства, так и иных сфер. Отличается тем, что в рамках одного программного решения ведет учет аналогичный системам 1С Бухгалтерия, Управление Торговлей и Зарплата и управление персоналом. Кроме того, имеет функции для ведения производственного учета и построения финансового учета в плате Бюджетирования. А также планирования и контроль производственных процессов (однако в довольно усеченном виде)
1С ERP и 1С Управление производственным предприятием (УПП)
Эти продукты — флагманские решения фирмы 1С. Они предназначены для интеграции в крупные предприятия, вне зависимости от их рода экономической деятельности, так как сочетают функции ведения регламентированного учета, зарплатного, по торговым и складским операциям, производственного на максимальном пределе имеющей функциональности, позволяя отражать процессы предприятий с высокой структурной сложностью и детализацией.
Данные решения показаны к применению во всех службах предприятия для достижения максимального эффекта по контролю за деятельностью предприятия и возможности принимать управленческие решения.
Назад к списку
электронных конфигураций
электронных конфигурацийСледующее содержание является сутью лекции по общей химии 26. В этой лекции мы продолжаем обсуждение квантовых чисел и их использования в электронных конфигурациях, а также отношения электронной конфигурации к периодическим свойствам элементов.
Электронная конфигурация
Конфигурации электронов — это сводка того, где электроны находятся вокруг ядра. Как мы узнали ранее, каждый нейтральный атом имеет количество электронов, равное количеству его протонов. Теперь мы поместим эти электроны в такое расположение вокруг ядра, которое укажет на их энергию и форму орбитали, на которой они расположены. Вот краткое изложение типов орбиталей и количества электронов, которые каждая из них может содержать:
Итак, основываясь на том, что мы знаем о квантовых числах, и используя приведенную выше таблицу, вам нужно 2 электрона, чтобы заполнить s-орбиталь, 6 электронов, чтобы заполнить p-орбиталь, 10 электронов, чтобы заполнить d-орбиталь, и 14 электронов, чтобы заполнить f-орбиталь. НО то, что мы не обсуждали, так это то, как эти орбитали заполняются… порядок заполнения.
НО то, что мы не обсуждали, так это то, как эти орбитали заполняются… порядок заполнения.
Порядок заполнения
Порядок, в котором электроны размещаются на орбиталях, основан на порядке их энергии. Это называется принципом Ауфбау. Первыми заполняются самые низкоэнергетические орбитали. Как и сами квантовые числа, этот порядок был определен расчетным путем и представлен следующей диаграммой:
или вы можете просто использовать периодическую таблицу:
Как написать электронную конфигурацию
Символы, используемые для записи электронной конфигурации, начинаются с номера оболочки (n), за которым следует тип орбитали, и, наконец, верхний индекс указывает, сколько электронов находится на орбитали.
Например:
Глядя на периодическую таблицу, вы видите, что кислород имеет 8 электронов. Основываясь на приведенном выше порядке заполнения, эти 8 электронов заполнили бы следующий порядок 1s, 2s и затем 2p. Таким образом, электронная конфигурация кислорода будет O 1s 2 2s 2 2p 4 .
Основываясь на приведенном выше порядке заполнения, эти 8 электронов заполнили бы следующий порядок 1s, 2s и затем 2p. Таким образом, электронная конфигурация кислорода будет O 1s 2 2s 2 2p 4 .
Особые случаи
Конфигурации ионов представляют собой частный случай электронной конфигурации, а также в первую очередь демонстрируют причину образования этих ионов.
Если вам нужно записать полную электронную конфигурацию для аниона , то вы просто добавляете дополнительные электроны, и конфигурация просто продолжается.
Например, мы знаем, что кислород всегда образует 2-ионы, когда он образует ион. Это добавит 2 электрона к его нормальной конфигурации, создав новую конфигурацию: O 2- 1с 2 2с 2 2п 6 . Следует отметить, что с 10 электронами электронная конфигурация кислорода теперь точно такая же, как у неона.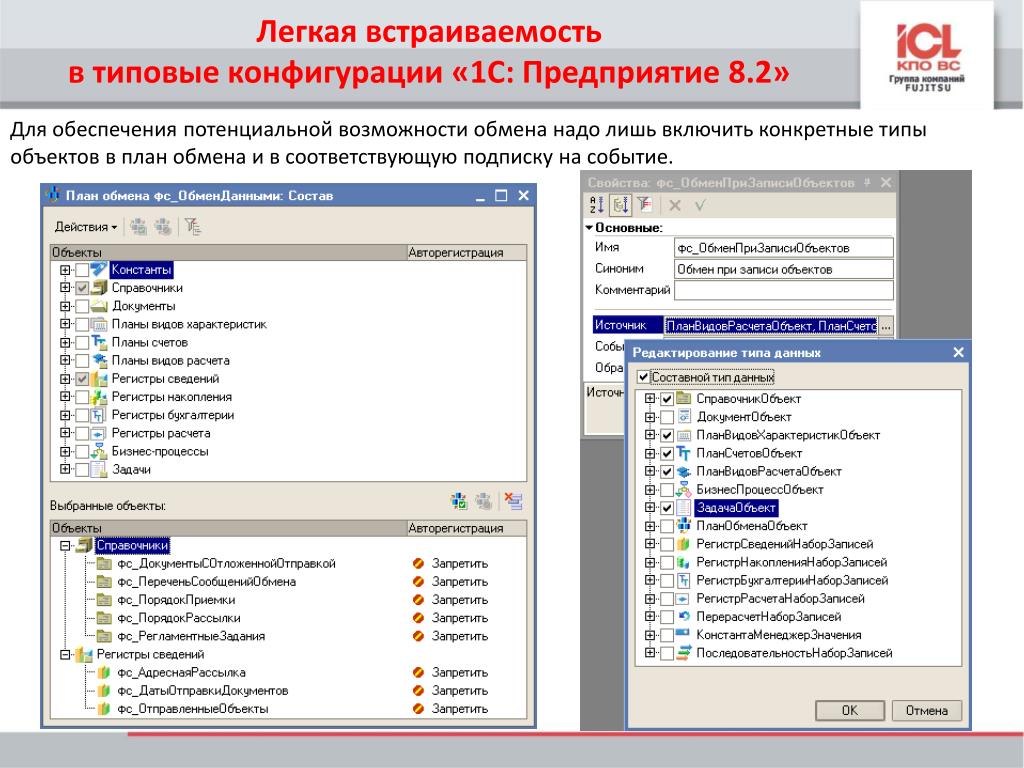 Мы говорили о том, что ионы образуются, потому что они могут стать более стабильными с присоединением или потерей электронов, чтобы стать похожими на благородные газы, и теперь вы можете увидеть, как они становятся такими же.
Мы говорили о том, что ионы образуются, потому что они могут стать более стабильными с присоединением или потерей электронов, чтобы стать похожими на благородные газы, и теперь вы можете увидеть, как они становятся такими же.
Электронные конфигурации катионов также основаны на количестве электронов, но есть небольшая разница в способе их конфигурации. Сначала вы должны написать их нормальную электронную конфигурацию, а затем, когда вы удаляете электроны, вы должны брать их с самой внешней оболочки. Обратите внимание, что это не всегда тот же способ, которым они были добавлены.
Вот пример того, что я имею в виду:
Iron имеет 26 электронов, поэтому его нормальная конфигурация электронов будет: FE 1S 2 2S 2 2P 6 3S 2 3P 6 4S 2 3D 6 2 3D 6
9 3 2 3D 6 2 3D 6 2 3D 6 2 3D 6Когда мы создаем ион 3+ для железа, нам нужно сначала взять электроны из самой внешней оболочки, чтобы это была оболочка 4s, а не оболочка 3d: Fe 3+ 1s 2 2s 2 2p 6 3s 2 3p 6 3d 5
Еще одно замечание по записи электронных конфигураций: короткий путь. При написании некоторых конфигураций нижних таблиц общая конфигурация может быть довольно длинной. В этих случаях вы можете использовать предыдущий благородный газ для сокращения конфигурации, как показано ниже. Вам просто нужно закончить конфигурацию, откуда выходит благородный газ:
При написании некоторых конфигураций нижних таблиц общая конфигурация может быть довольно длинной. В этих случаях вы можете использовать предыдущий благородный газ для сокращения конфигурации, как показано ниже. Вам просто нужно закончить конфигурацию, откуда выходит благородный газ:
Исключения
Как и в случае с любой другой темой, которую мы рассмотрели на сегодняшний день, существуют исключения из порядка заполнения. Но, исходя из генерируемых электронных конфигураций, эти исключения легко понять.
В блоке d, особенно в группах, содержащих хром и медь, есть исключение в том, как они заполняются.
Вот актуальные конфигурации:
В этих столбцах 4s и 3d
Практика, Практика, Практика
Здесь есть множество викторин по электронным конфигурациям, с которыми вы можете попрактиковаться
Орбитальные диаграммы
Еще один способ представить порядок заполнения атома — использовать орбитальную диаграмму, которую часто называют «маленькими квадратиками»:
Прямоугольники используются для представления орбиталей и для отображения размещенных на них электронов. Порядок заполнения тот же, но, как вы можете видеть сверху, электроны помещаются в ящики по одному, прежде чем заполнить их обоими электронами. Это называется правилом Хунда: «Заполните наполовину, прежде чем заполнить полностью», и снова это правило было установлено на основе расчетов энергии, которые показали, что именно так атомы фактически распределяют свои электроны по орбиталям.
Порядок заполнения тот же, но, как вы можете видеть сверху, электроны помещаются в ящики по одному, прежде чем заполнить их обоими электронами. Это называется правилом Хунда: «Заполните наполовину, прежде чем заполнить полностью», и снова это правило было установлено на основе расчетов энергии, которые показали, что именно так атомы фактически распределяют свои электроны по орбиталям.
Периодические свойства
Одна из действительно крутых особенностей электронных конфигураций — их связь с периодической таблицей. В основном периодическая таблица была построена таким образом, чтобы элементы с одинаковыми электронными конфигурациями были выровнены в одни и те же группы (столбцы).
Периодическая таблица, показывающая последнюю заполненную орбиту для каждого элемента
Периодическая таблица, показанная выше, демонстрирует, как конфигурация каждого элемента была выровнена так, чтобы последняя заполненная орбиталь была такой же, за исключением оболочки. Причина, по которой это было сделано, заключается в том, что конфигурация элемента придает элементу его свойства, а аналогичные конфигурации дают аналогичные свойства.
Причина, по которой это было сделано, заключается в том, что конфигурация элемента придает элементу его свойства, а аналогичные конфигурации дают аналогичные свойства.
Давайте рассмотрим некоторые периодические свойства, на которые напрямую влияет электронная конфигурация:
Размер атома
Размер атомов увеличивается вниз по таблице Менделеева. Это должно быть интуитивно понятно, поскольку с каждой строкой таблицы вы добавляете оболочку (n). Что не так интуитивно понятно, так это то, почему размер уменьшается слева направо. Но опять же построение электронной конфигурации дает нам ответ. Что вы делаете, просматривая периодическую таблицу? Ответить, добавляя протоны к ядру и добавляя электроны к валентной оболочке элемента. Что не меняется, когда вы пересекаете период? Ответ: электроны внутренней оболочки. Подумайте об этом так: электроны внутренней оболочки являются защитой от притяжения ядра. Так, например, сила притяжения Sulphur будет равна Z Eff = 16 — 10 = +6 |
Электроотрицательность
Электроотрицательность может быть самым важным из периодических свойств, которые вы можете изучить и понять, так как многие другие свойства зависят от его значения.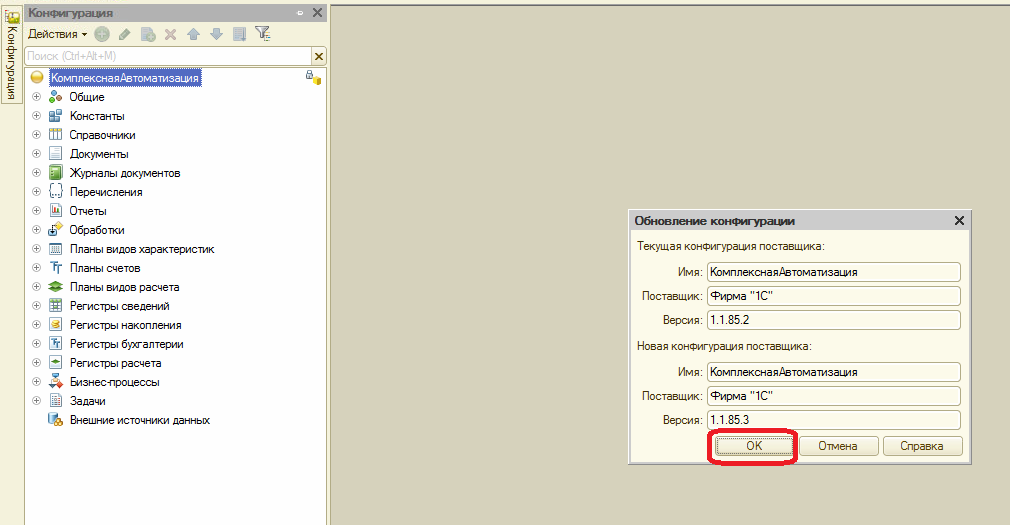 Электроотрицательность — это способность атомов притягивать к себе электроны.
Электроотрицательность — это способность атомов притягивать к себе электроны.
Электроотрицательность обычно выражается по шкале Полинга, и значения были определены экспериментально. В таблице ниже показаны значения шкалы для элементов.
Значения электроотрицательности увеличиваются слева направо и снизу вверх в периодической таблице, за исключением благородных газов. Наиболее электроотрицательным элементом является фтор.
Из этих значений электроотрицательности мы можем вывести модели двух других периодических свойств: энергии ионизации и сродства к электрону.
Энергия ионизации Энергия ионизации — это количество энергии, необходимое для отрыва электрона от атома. Все энергии ионизации являются положительными значениями, потому что все эти удаления (даже для элементов, образующих положительные ионы) требуют ввода энергии. Чем более электроотрицательный элемент, тем выше энергия ионизации. | |
Электронное сродствоЭлектронное сродство элемента — это количество энергии, полученное или высвобожденное при добавлении электрона. Электроотрицательность и сродство к электрону увеличиваются по той же схеме в периодической таблице. Слева направо и снизу вверх. |
1.6: Электронные конфигурации — правило Хунда
- Последнее обновление
- Сохранить как PDF
- Идентификатор страницы
- 13620
В разделе Ауфбау обсуждалось, как электроны сначала заполняют орбитали с самой низкой энергией, а затем перемещаются на орбитали с более высокой энергией только после того, как орбитали с более низкой энергией будут заполнены. Однако с этим правилом есть проблема. Конечно, 1s-орбитали должны быть заполнены до 2s-орбиталей, потому что 1s-орбитали имеют более низкое значение \(n\) и, следовательно, более низкую энергию. Как насчет заполнения трех разных 2p-орбиталей? В каком порядке они должны быть заполнены? Ответ на этот вопрос связан с правилом Хунда.
Однако с этим правилом есть проблема. Конечно, 1s-орбитали должны быть заполнены до 2s-орбиталей, потому что 1s-орбитали имеют более низкое значение \(n\) и, следовательно, более низкую энергию. Как насчет заполнения трех разных 2p-орбиталей? В каком порядке они должны быть заполнены? Ответ на этот вопрос связан с правилом Хунда.
Правило Хунда утверждает, что:
- Каждая орбиталь на подуровне занята однократно до того, как любая орбиталь будет занята дважды.
- Все электроны на однократно занятых орбиталях имеют одинаковый спин (чтобы максимизировать общий спин).
При назначении электронов орбиталям электрон сначала стремится заполнить все орбитали с одинаковой энергией (также называемые вырожденными орбиталями), прежде чем соединиться с другим электроном на наполовину заполненной орбитали. Атомы в основном состоянии имеют как можно больше неспаренных электронов. Визуализируя этот процесс, рассмотрите, как электроны ведут себя так же, как те же полюса магнита, если бы они вступили в контакт; поскольку отрицательно заряженные электроны заполняют орбитали, они сначала пытаются удалиться как можно дальше друг от друга, прежде чем им придется соединиться.
Пример \(\PageIndex{1}\): Атомы азота
Рассмотрим правильную электронную конфигурацию атома азота (Z = 7): 1s 2 2s 2 2p 3
3 орбитали заполнены наполовину; три электрона и три р-орбитали. Это связано с тем, что три электрона в подоболочке 2p сначала заполнят все пустые орбитали, прежде чем спариться с электронами на них.
Имейте в виду, что элементарный азот обычно встречается в природе в виде молекулярного азота \(\ce{N2}\), для которого требуются молекулярные орбитали вместо атомных орбиталей, как показано выше.
Пример \(\PageIndex{2}\): Атомы кислорода
Далее рассмотрим атом кислорода (Z = 8), элемент после азота в тот же период; его электронная конфигурация: 1s 2 2s 2 2p 4
У кислорода на один электрон больше, чем у азота; поскольку все орбитали заполнены наполовину, новый электрон должен спариться. Имейте в виду, что элементарный кислород обычно встречается в природе в виде молекулярного кислорода \(\ce{O_2}\), который имеет молекулярные орбитали вместо атомных орбиталей, как показано выше.
Объяснение правила Хунда
Согласно первому правилу, электроны всегда входят на пустую орбиталь, прежде чем спариться. Электроны заряжены отрицательно и в результате отталкиваются друг от друга. Электроны имеют тенденцию минимизировать отталкивание, занимая свои собственные орбитали, а не разделяя орбиталь с другим электроном. Кроме того, квантово-механические расчеты показали, что электроны на однократно занятых орбиталях менее эффективно экранированы или экранированы от ядра. Электронное экранирование обсуждается далее в следующем разделе.
Согласно второму правилу, неспаренные электроны на однократно занятых орбиталях имеют одинаковые спины. С технической точки зрения, первый электрон на подуровне может иметь как «спин вверх», так и «спин вниз». Однако после выбора спина первого электрона на подуровне спины всех остальных электронов на этом подуровне зависят от этого первого спина. Чтобы избежать путаницы, ученые обычно изображают первый электрон и любой другой неспаренный электрон на орбитали как «спин вверх».
Пример \(\PageIndex{3}\): Углерод и кислород
Рассмотрим электронную конфигурацию атомов углерода: 1s 2 2s 2 2p 2 : два 2s-электрона будут занимать одну и ту же орбиталь, тогда как два 2p-электрона будут находиться на разных орбитах (и выровнены в одном направлении). в соответствии с правилом Хунда.
Рассмотрим также электронную конфигурацию кислорода. У кислорода 8 электронов. Электронная конфигурация может быть записана как 1s 2 2s 2 2p 4 . Чтобы нарисовать орбитальную диаграмму, начните со следующих наблюдений: первые два электрона образуют пары на 1s-орбитали; следующие два электрона объединятся в пары на 2s-орбитали. Остаются 4 электрона, которые должны быть размещены на 2р-орбиталях. Согласно правилу Хунда, все орбитали будут заняты однократно, прежде чем любая из них будет занята дважды. Следовательно, две p-орбитали получат один электрон, а одна будет иметь два электрона. Правило Хунда также гласит, что все неспаренные электроны должны иметь одинаковый спин. В соответствии с соглашением, неспаренные электроны изображены как «спин вверх», что дает (рис. 1).
В соответствии с соглашением, неспаренные электроны изображены как «спин вверх», что дает (рис. 1).
Назначение электронных конфигураций
Когда атомы вступают в контакт друг с другом, первыми взаимодействуют внешние электроны этих атомов, или валентная оболочка. Атом наименее стабилен (и, следовательно, наиболее реактивен), когда его валентная оболочка не заполнена. Валентные электроны в значительной степени ответственны за химическое поведение элемента. Элементы с одинаковым числом валентных электронов часто имеют сходные химические свойства.
Электронные конфигурации также могут предсказывать стабильность. Атом наиболее стабилен (и, следовательно, неактивен), когда все его орбитали заполнены. Наиболее стабильными являются конфигурации с полными энергетическими уровнями. Эти конфигурации встречаются в благородных газах. Благородные газы — очень стабильные элементы, которые не реагируют легко ни с какими другими элементами. Конфигурации электронов могут помочь в предсказании того, как определенные элементы будут реагировать, а также химических соединений или молекул, которые будут образовывать различные элементы.
 Когда вы пересекаете период и увеличиваете количество протонов в ядре, вы увеличиваете его притяжение, но поскольку вы только добавляете электроны в новую оболочку, экран не увеличивается, а остается неизменным на всем протяжении. Это означает, что притяжение электронов, добавляемых к валентной оболочке, неуклонно увеличивается на всем протяжении. Что произойдет, если вы потянете электроны сильнее? Ну, они приближаются к ядру и размер атома уменьшается. Эффект притяжения ядра на электроны, добавляемые за период, называется эффективным зарядом ядра и рассчитывается как Z Eff = #протоны — Ядро # Электроны.
Когда вы пересекаете период и увеличиваете количество протонов в ядре, вы увеличиваете его притяжение, но поскольку вы только добавляете электроны в новую оболочку, экран не увеличивается, а остается неизменным на всем протяжении. Это означает, что притяжение электронов, добавляемых к валентной оболочке, неуклонно увеличивается на всем протяжении. Что произойдет, если вы потянете электроны сильнее? Ну, они приближаются к ядру и размер атома уменьшается. Эффект притяжения ядра на электроны, добавляемые за период, называется эффективным зарядом ядра и рассчитывается как Z Eff = #протоны — Ядро # Электроны.